в продолжение «Развитие и течение состояния пристрастия«
Аннотация
Содержание
- 0.1 Аннотация
- 0.2 Нейробиология аддикций
- 0.3 Опиоидная зависимость
- 0.4 Изменения в эндогенных лигандах
- 0.5 Пластичность нейронных цепей
- 0.6 Роль переносчика глутамата
- 0.7 Системы других нейромедиаторов
- 1 Алкогольная зависимость
- 2 Никотиновая зависимость
- 3 Кокаиновая зависимость
- 4 Каннабиноидная зависимость
- 5 Развивающиеся стратегии лечения
Наркотическая зависимость является основной причиной возникновения заболеваний и снижения работоспособности. В попытках объяснить это состояние создавались различные теории, начиная с экономических и заканчивая психологическими. C появлением возможности исследовать клеточный и субклеточный уровни изменились взгляды на этиологию наркотической зависимости. Вероятно, главным открытием стала идентификация специфических рецепторов для каждого наркотического вещества, их целевых нейромедиаторных систем и вызываемых ими внутриклеточных изменений. Эти рецепторы также выступают в роли потенциальных мишеней, способствующих лечению наркозависимости. В данном обзоре авторы попытались представить механизмы развития зависимости и новые стратегии ее лечения для наиболее часто употребляемых наркотиков, таких как алкоголь, опиоиды, каннабис, никотин и кокаин.
Клеточная биология изучает физиологию и биохимию внутриклеточных процессов. Молекулярная биология — это отрасль биологии, которая стремится описать все биологические процессы с точки зрения генов и генетических изменений. Со становлением нейробиологии как незаменимой сферы биомедицинских исследований произошел быстрый рост в понимании процессов, лежащих в основе НЗ на клеточном и молекулярном уровнях. В этом дополнении авторы описали результаты недавних исследований с целью добиться лучшего понимания деталей, касающихся синдрома наркотической зависимости.
Нейробиология аддикций
Наркотическая зависимость является сложным затяжным патологическим процессом, происходящим в мозге и регулирующимся генетическими факторами, эволюционными и факторами окружающей среды. Наиболее достоверным и воспроизводимым открытием в исследовании наркотической зависимости стало то, что злоупотребление наркотическими веществами (далее: НВ) активирует мезолимбическую дофаминергическую систему, которая усиливает как фармакологические, так и естественные источники системы вознаграждения. Мезолимбическая система состоит из дофаминергических нейронов, находящихся в вентральной покрышечной области (VTA), и их аксонов, находящихся в терминальных областях прилежащего ядра (лат. nucleus accumbens) и в префронтальной коре.
Опиоиды, алкоголь, никотин, каннабиноиды и психостимуляторы — все они действуют на эту систему с целью увеличения синаптических уровней дофамина (DA). Эти вещества имеют специфические рецепторы в головном мозге, и возрастание уровня дофамина в мезолимбической системе является конечным эффектом их действия. Рецептор-опосредованная активность — это основной принцип работы любых химических медиаторов. Химические медиаторы — это регуляторные макромолекулы, обычно белки. У рецепторов есть 2 основные функции: распознавание и трансдукция. Соответственно, каждый рецептор имеет 2 домена: лиганд-связывающий и эффекторный домен. Лиганд-связывающий домен имеет гидрофильный и липофильный участки, а также обычно является гетерополимером. Присоединение лиганда вызывает изменение в четвертичной структуре рецептора.
Рецепторы имеют разнообразные эффекторные механизмы, из которых наиболее распространены четыре типа:
-
G-белковые рецепторы (Gs, Gi, Gq, G13);
-
Рецепторы ионных каналов;
-
Каталитические рецепторы;
-
Рецепторы, регулирующие экспрессию генов.
Одним из самых впечатляющих успехов в изучении наркомании стало определение мишени каждого из наиболее часто применяемых наркотиков. Этот успех стал возможен благодаря развитию методов радиолигандного связывания, с возможностью определения биохимических характеристик участков, связывающих НВ, и в конечном итоге с применением молекулярной биологии для клонирования и выделения этих структур. Различные виды наркотиков и соответствующие им рецепторы представлены в Таблице 1.
Наркотические вещества могут как повышать, так и понижать регуляцию чувствительных рецепторов и их механизмов действия [Таблица 2]. Эти изменения, осуществляемые посредством генетических механизмов, связаны с развитием устойчивости к НВ и синдромом отмены. Ранние биохимические данные поддерживали представление о том, что место действия НВ является гомогенным. Однако сейчас известно огромное разнообразие взаимодействий между наркотическим веществом и рецептором. Например, считалось, что никотин имеет класс гомогенных центров связывания в головном мозге. Сейчас же известно, что существует множество различных олигомерных рецепторов, которые связываются и активируются никотином.
И разнообразие типов рецепторов, и кросс-модальность взаимодействий между наркотическим веществом и рецептором становятся все более и более значимыми. Ранее считалось, что применение наркотиков вызывает изменения в специфических центрах связывания, в механизмах инактивации или в уровнях эндогенных лигандов. На данный момент разнообразие рецепторов НВ вынуждает нас выяснить, происходят ли изменения в структуре рецепторной молекулы или в количестве этих рецепторов на поверхности нейронов. Злоупотребление наркотиками имеет и долгосрочные последствия, обусловленные активацией экспрессии генов в результате действия препарата.
Опиоидная зависимость
Было предложено несколько механизмов для объяснения опиоидной зависимости.
Гипотеза цАМФ
Опиоидные рецепторы действуют путем снижения активности аденилатциклазы, что приводит к снижению уровня внутриклеточного цАМФ. Это было обнаружено Sharma с соавт.[1],когда они продемонстрировали снижение уровня внутриклеточной цАМФ после добавления морфина к культуре клеток нейробластомы. Тем не менее при продолжающемся воздействии уровень цАМФ возвращается в норму, а при добавлении антагониста опиоидных рецепторов концентрация цАМФ превышает контрольные значения. Это показало, что устойчивость и зависимость возникли на клеточном уровне. Предположительно, процессы адаптации в сигнальном пути цАМФ способствуют появлению устойчивости к опиоидам и зависимости от них. Это было названо гипотезой цАМФ опиоидной зависимости. Хроническое воздействие опиоидов вызвало индукцию аденилатциклазы и протеинкиназы А, но после отмены опиоидов произошло резкое снижение концентрации этих ферментов. Кроме того, было обнаружено, что все три типа опиоидных рецепторов подверглись развитию устойчивости.[2] Также было выяснено, что механизм развития устойчивости к агонистам каппа-рецепторов состоит в разобщении рецептора и G-белка,[3] опосредованном киназой бета-адренергических рецепторов.[4]
Изменения в проводимости ионов
Активация опиоидных рецепторов может изменять проницаемость мембран для ионов калия. Активация протеинкиназы С может ослаблять активность опиоидных рецепторов и влиять на ионную проводимость.[5]
Изменения в эндогенных лигандах
Хроническое употребление морфина вызывает ответное ингибирование синтеза эндогенных опиоидов, которое в дальнейшем ведет к опиоидной зависимости и синдрому отмены.[6] Было показано, что опиоидные агонисты уменьшают экспрессию мРНК проэнкефалинов.[7] С другой стороны, опиоидные антагонисты усиливают их экспрессию или увеличивают синтез энкефалиновых пептидов в некоторых клетках. Это указывает на то, что опиоидные рецепторы имеют прямое и косвенное влияние на гены, регулирующие синтез эндогенных опиоидов.
Пластичность нейронных цепей
Подобное происходит посредством антиопиоидных нейронов, к примеру, использующих в качестве нейромедиаторов ноцицептин/орфанин FQ, глутамат, холецистокинин или нейропептид FF. Исследование показало потерю устойчивости к морфину у мышей с нокаутом гена ноцицептина-орфанина (NOP). Спровоцированный налоксоном синдром отмены морфина был заметно ослаблен у мышей с нокаутом гена NOP.[8]
Роль переносчика глутамата
Было обнаружено, что в полосатом теле и прилежащем ядре морфинозависимых крыс была повышена экспрессия глиального переносчика глутамата и мРНК гамма интерферон-индуцированной лизосомальной тиольной редуктазы, а у крыс с отменой морфина, наоборот, показатели были понижены.[9] Активатор переносчика глутамата ингибировал развитие физической и психической зависимости от морфина.[9]
Системы других нейромедиаторов
В развитие неонатальной устойчивости к морфину вовлечен рецептор эндотелина А.[10] In vitro отмена опиоидов спровоцировала опиоид-чувствительный катионный ток, опосредованный ГАМК переносчиком-1 (GAT-1). GAT-1 может стать целью для терапии, ослабляющей проявления синдрома отмены.[11] Также было обнаружено, что субстанция P (SP) способна изменять экспрессию устойчивости к опиатам и синдрома отмены у грызунов.[12]
Алкогольная зависимость
ГАМК-ергическая система
При исследовании эффектов алкоголя на ГАМК-опосредованный захват ионов хлора (CL-) в “микромешочках” мозга (изолированные слившиеся мембраны клеток мозга) было обнаружено, что захват CL- увеличился. Таким образом алкоголь мог усилить ГАМК-опосредованное ингибирование нейронов.[13] Каждый рецептор ГАМК состоит из пяти субъединиц, которые образуют канал в центре комплекса.
Хроническое употребление алкоголя снизило функцию ГАМКА рецептора, в связи с чем для вызова припадков были необходимы меньшие дозы антагонистов ГАМКА. Единичный прием алкоголя усилил ГАМК-индуцированный ток CL- в микромешочки мозга у мышей, но подобный эффект не возникал после постоянного приема алкоголя.[14]
Результаты анализов показали, что постоянное получение крысами алкоголя ведет к снижению уровня мРНК одной из альфа субъединиц рецептора (т.е. альфа 1 субъединицы), а также к снижению уровня белка альфа 1.[14] Эти данные подтверждают гипотезу о том, что развитие устойчивости связано с уменьшением количества ГАМКА-рецепторов.
Глутаматергическая система
Алкоголь снижает передачу в NMDA-рецепторах глутамата. Было замечено, что экспрессия определенных субъединиц рецепторов NMDA в коре увеличена у людей с алкогольной зависимостью.[15] Отклонения в работе NMDA-рецепторов (оцениваемые по ответу на кетамин) могут способствовать субъективному ответу на прием этанола и увеличивать риск развития алкоголизма.[16]
Серотонинергическая система
Низкие уровни 5-гидроксииндолуксусной кислоты (CSF HIAA) в ликворе ассоциируются с быстрым развитием алкоголизма, агрессивностью и сильной импульсивностью.[17-18] Существуют данные, что селективные ингибиторы обратного захвата серотонина (SSRIs) — циталопрам и флукостеин — уменьшают потребление алкоголя.[19-21] Плотность переносчиков серотонина была ниже в коре алкоголиков (в периколенной и передней поясной коре).[22]
Дофаминергическая система
Хроническое употребление алкоголя было связано с уменьшением активности мезостриальной дофаминергической системы у грызунов и концентрации дофамина и его метаболитов у пациентов-алкоголиков.[23] Снижение функции дофаминергической системы привело к компенсаторным адаптационным изменениям D2-рецепторов (гиперчувствительность и увеличение их количества).[24] Алкоголезависимые пациенты, у которых произошел ранний срыв, имели низкий уровень дофамина и повышенное количество D2-рецепторов. Было предложено использовать этот показатель как биологический маркер риска раннего рецидива у пациентов, страдающих хроническим алкоголизмом.[25] Полногеномный поиск ассоциаций полиморфизма генов нейромедиаторов у алкоголиков-европиоидов показал значительное преобладание полиморфизма гена D2-рецептора (DRD2 TaqI B1 аллель).[28]
Эндоканнабиноидная система
Хронический алкоголизм приводит к снижению количества CB1-рецепторов эндоканнабиноидной системы и их проводящей сигналы системы, а также вызывает увеличение эндогенных каннабиноидов: арахидонилэтаноламида и 2-арахидоноилглицерола.[27] Удаление рецептора CB1 блокирует добровольное потребление алкоголя у крыс.[28] Также антагонист CB1, SR141716, снижает потребление алкоголя среди грызунов.[29,30]
Система глицина
Рецепторы глицина (GlyR) в прилежащем ядре могут выступать в качестве мишеней для алкоголя при его действии на мезолимбическую дофаминергическую систему.[31] Глицин и стрихнин изменяют внеклеточную концентрацию дофамина в прилежащем ядре, вероятно, через активирование и ингибирование GlyR. Глицин и стрихнин обоюдно влияют на потребление алкоголя среди самцов крыс линии Вистар, в большей степени предпочитающих алкоголь.[32]
Протеомика алкоголизма
Пероксиредоксин, креатинкиназа, белки, связывающие жирные кислоты, — это некоторые белки, экспрессия которых повышена у хронических алкоголиков. Экспрессия синуклеина, тубулина, енолаз, напротив, понижена. Эти белки связаны с нейродегенерацией при хроническом алкоголизме, а некоторые из них совпадают с изменениями при болезни Альцгеймера.[26]
Никотиновая зависимость
Холинергическая система
Никотин воздействует на никотинзависимые холинорецепторы. Разные комбинации альфа и бета субъединиц образуют рецепторы с различным ответом на агонистов и антагонистов. Чувствительность рецептора к агонистам и антагонистам зависит от субъединиц, входящих в состав рецептора. При стимуляции никотиновых рецепторов никотином происходит отключение рецептора.
Таким образом, дофаминергическая стимуляция нейронов мезолимбической системы прекращается довольно быстро после воздействия низкой концентрацией никотина. Следовательно, эффекты никотина саморегулируются, и его влияние на поведение не так выражено, как у кокаина. Количество участков связывания изменяется при постоянном употреблении никотина.[5, 33, 34] При отмене никотина у крыс активируется аденилатциклаза в миндалевидном теле. Аденилатциклазная активность стимулируется кальций-кальмодулиновой системой (как и в случае опиоидной и каннабиноидной абстиненции).[35]
ГАМК и метаботропные рецепторы глутамата
2-метил-6-(фенилэтинил)-пиридин (MPEP), антагонист метаботропного рецептора глутамата подтипа 5 (mGluR5), уменьшил потребление никотина крысами. Таким образом, соединения, увеличивающие ГАМК-ергическую передачу, и mGluR5 антагонисты глутаматных рецепторов могут быть использованы в качестве препаратов, направленных против курения.[36]
Опиоидергическая система
24-часовое воздержание от приема никотина вызвало значительное увеличение уровня мРНК препроэнкефалинов в гиппокампе и полосатом теле. При предварительном назначении мекамиламина крысам данные эффекты были заблокированы. Предполагается, что опиоидная система мозга вовлечена в передачу сигнала никотина и в возникновение синдрома отмены.[37]
Кокаиновая зависимость
Моноаминергическая система
Кокаин является ингибитором транспортеров моноаминов, особенно дофамина, а также оказывает небольшой эффект на транспортеры серотонина и норадреналина. В исследовании Hall 2004 года[7] было видно, что мыши с нокаутом гена переносчиков дофамина продолжили получать удовольствие при употреблении кокаина. Так, были созданы мыши с нокаутом генов переносчиков серотонина и норадреналина. При нокауте генов переносчиков и дофамина, и серотонина система вознаграждения не активировалась при потреблении кокаина. При нокауте генов переносчиков серотонина и норадреналина у мышей, наоборот, наблюдалась повышенная активация системы вознаграждения.[7]
Роль каннабиноидов в употреблении кокаина
Агонисты каннабиноидов, HU210, провоцируют повторное употребление кокаина после отказа от наркотика. Антагонисты каннабиноидных рецепторов предотвращают рецидив.[38] Селективный антагонист CB1-рецепторов, SR141716A, ослабляет рецидив, вызванный повторным воздействием на связанные с кокаином раздражители или прием кокаина.
Эффект на транскрипционный фактор FosB
Чрезмерная экспрессия FosB повышает чувствительность к локомоторному эффекту кокаина и морфина, а также к системе вознаграждения. Кроме того, возрастает самопроизвольное употребление кокаина и усиливается стимул к его поиску.[39]
Каннабиноидная зависимость
Каннабис воздействует на рецепторы каннабиноидов CB1 (центральные) и CB2 (иммунные клетки). CB1-рецепторы ингибируют аденилатциклазу и кальциевые каналы, активируют калиевые каналы и митоген-активируемую протеинкиназу. Острые эффекты каннабиноидов и развитие устойчивости опосредовано рецепторами, связанными с G-белками.
Для исследования метаболизма печени при устойчивости к дельта-9-тетрагидроканнабинолу лабраторным животным предварительно вводили SKF-525A (микросомальный ингибитор ферментов) или фенобарбитал (микросомальный усилитель ферментов). Полученные данные позволили предположить (но не окончательно продемонстрировать) метаболический механизм развития устойчивости. Было обнаружено, что литий предотвращает синдром отмены каннабиса (повышенная экспрессия Fos-белков в окситоцин-иммунореактивных нейронах, а также увеличение экспрессии мРНК окситоцина и концентрации окситоцина в периферической крови). Эффекты лития ослабевали при систематическом превентивном назначении антагонистов окситоцина.
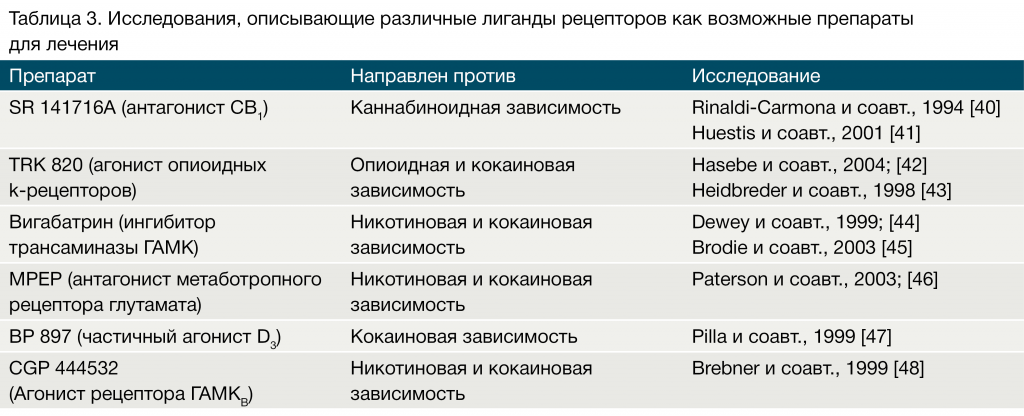
Открытие молекулярных механизмов наркотической зависимости привело к идентификации лигандов, которые могут быть надежными вариантами для лечения. Таблица 3.
Развивающиеся стратегии лечения
18—Метоксикоронаридин (18-MC) снижает употребление наркотиков у некоторых моделей животных. Таким образом, это может быть потенциальным лекарством для множества форм наркотической зависимости (антагонист альфа-3-бета-4 никотиновых рецепторов).[49]
 Заключение
Заключение
Основной конечный механизм действия наркотических веществ связан с дофамином в лимбической системе. Постоянное употребление наркотиков ведет к молекулярным изменениям во многих нейромедиаторных системах, и, таким образом, различные системы нейромедиаторов вовлечены в развитие зависимости от одного конкретного наркотика. Изучение нейробиологической основы аддиктивных процессов позволяет лучше понять существующую фармакотерапию и в будущем приведет к развитию новых и более эффективных способов лечения.
Перевод: Владислав Ледовский
Редакция: Николай Лисицкий, Телли Мурадова, Алиса Скнар
Таблицы и обложка: Cornu Ammonis
Источники





![[Наркотическая] зависимость: миф о болезни мозга](http://www.socialcompas.com/wp-content/uploads/2017/02/cover1__w600-150x150.jpg)





