Недостатки, как правило, продолжают достоинства: главная опасность коммуникации следует из её главного плюса — передачи информации идеального характера, “кодируемой” теми или иными характеристиками специфических форм “материальных носителей” сигналов — демонстраций (визуальных, акустических, вибрационных и прочих). Эта передача “честная”, а значение сигналов “свободно”, т.е. независимо от контекста, поэтому информацию могут использовать особи, не вовлечённые во взаимодействие, даже для целей, противоречащих “интересам” источника сигналов, вроде “обмана”.
Второй вариант, более страшный для демонстратора — сигналы используют хищники для большей успешности охоты. Чем дольше демонстрируешь и/или чем ритуализованней демонстрации, тем выше риск гибели. Он иллюстрируется на двух примерах — брачных криков древесных лягушек и токования тетеревов: дальше показывается, что рост рискованности демонстрирования более эффективных сигналов ведёт к эволюции их в сторону ещё большей эффективности (и стереотипности демонстрирования, обеспечивающей нужную для этого степень типологической определённости формы сигнала), а вовсе не её умаления ради восстановления безопасности. Обретя опосредование действий сигналами, животные «не экономят» на информационном обмене даже в условиях прямой угрозы жизни, настолько он значим для биологии вида.
“Пение” древесных лягушек — гонг к обеду для летучих мышей
Содержание
«Любовная песня» тунгарских лягушек Engystomops pustulosus (сем. свистуны Leptodactylidae) для летучих мышей бахромчатогубых листоносов Trachops cirrhosus — гонг к обеду; ловят они и другие виды древесных лягушек вроде Smirsia sila (до 10).
Эффективная ловля древесных лягушек, ориентирующаяся именно и только на вокализации жертвы, дополнительно подтверждает семантичность их акустической формы1. Тем более что при выборе жертвы из “хора” самцов хищник использует те же характеристики крика, что определяют их большую или меньшую привлекательность для самок (Akre et al., 2011).
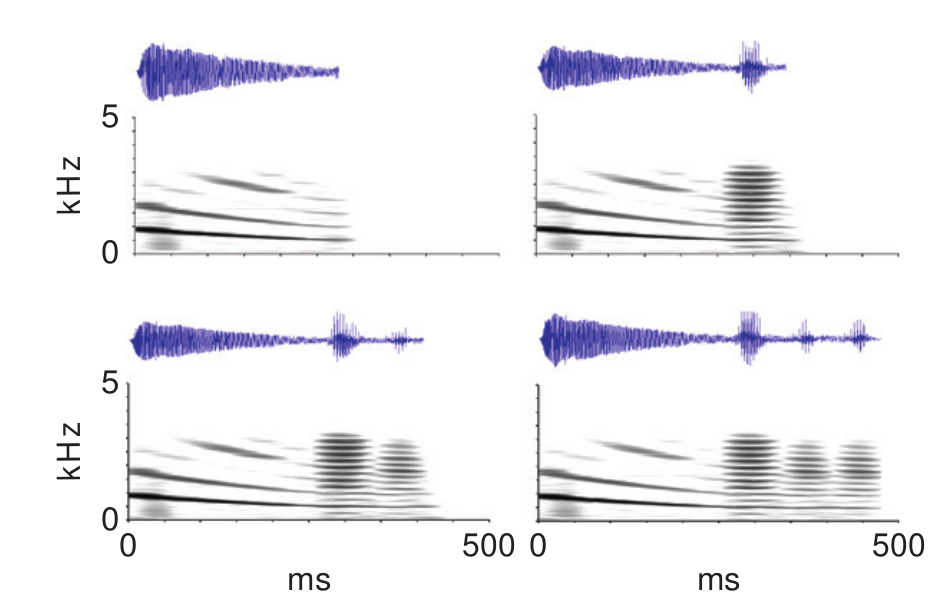
Двусоставная “песня” тунгарской лягушки, осцилло- (сверху) и спектрограммы. По часовой стрелке: единичное “скуление”; “скуление” со следующим за ним “квохтаньем”; то же с двумя и тремя “квохтаньями”. Источник Ryan, 2010.
 Слева самец тангарской лягушки “поёт”, раздувая резонатор; справа самец и самка в амплексусе. Источник Page, Bernal, 2006.
Слева самец тангарской лягушки “поёт”, раздувая резонатор; справа самец и самка в амплексусе. Источник Page, Bernal, 2006.
«Песня» включает два компонента: длинное частотно-модулированное «скуление» (англ. whine) из 5 гармоник и следующие за ним 1-7 коротких амплитудно-модулированных всплесков из 15 гармоник (chucks, «квохтанье»). Первый необходим и достаточен для появления фонотаксиса самки, второй усиливает его эффект, так что возможны песни и без него (Ryan, 2010).
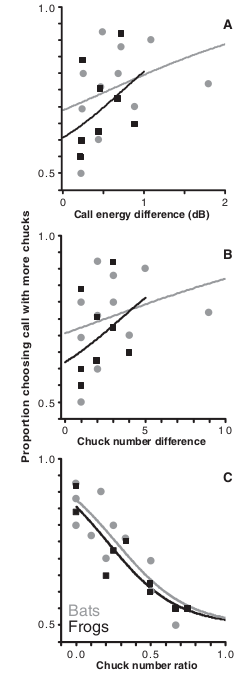
Рисунок 1. Сходства и различия в ориентации самок тунгарской лягушки vs хищных летучих мышей (чёрные и серые точки) по параметрам брачного крика самцов. Сверху вниз: разница в интенсивности звуковой стимуляции, дБ; разница в числе “кудахтаний”; соотношение “кудахтаний” и “скулений”. Ордината — доля выборов крика с большим числом “кудахтаний”. Кривые — аппроксимация методом наименьших квадратов психометрической функции (закон Вебера-Фехнера) для случая 0,5 (нет предпочтений) и 1,0 (полное предпочтение). Из: Akre et al., 2011.
Самки и листоносы равно предпочитают самцов с более сложными криками, включающими оба компонента, но с низкой частотой «квохтаний» и «скулений», т. е. более крупных, и с большим числом «квохтаний». В выборе между двумя источниками, издающими разные варианты брачного крика на равном расстоянии от тестируемых самок их предпочтение «скулений» с «квохтаньем» одиночному «скулению» было пятикратным. Более интенсивная конкуренция между самцами увеличивает число «квохтаний» после “скуления”, тем самым повышая их общую уязвимость для хищника: уязвимость каждого отдельного самца растёт намного медленней, см.ниже.
Самок, отловленных в дикой природе, тестировали двумя разными типами вокализаций, динамики располагались в противоположных концах экспериментальной камеры. Предпочтение определяли как число явных приближений к одному из динамиков на дистанцию >10 см. Использовали пары криков со следующим соотношением числа «квохтаний» после “скуления”: 1:2, 1:3, 1:4, 1:5, 2:3, 2:4, 3:4 (≥40 повторностей каждой пары стимулов, 151 самка). В анализ включили также уже опубликованные данные по выбору самками между парами криков со следующими пропорциями числа «квохтаний»: 0:1 и 0:3, всего 25 повторностей. Общее число выборов составило 331 (Akre et al., 2011).
Авторы проверили три гипотезы, могущие объяснить выявленное предпочтение более сложных сигналов (оценено индексом, варьирующим от 0,5, нет предпочтения, до 1 — все выбирают крик, где больше «квохтаний»).
1. Предпочтение задано общей интенсивностью стимуляции самки, т. е. пропорцией общей акустической энергии, присутствующей в “скулениях” и «квохтаниях» каждого из сопоставляемых стимулов. Она объясняет лишь 16,5% дисперсии выборов (P = 0,278; рис. 1A). 2. Столь же мало предиктивна гипотеза, что выбор зависим от разницы числа “кудахтаний” в сопоставляемых стимулах (объясняет лишь 11,8% вариации выбора самок, Р = 0,366; рис. 1B). Психометрический закон Вебера-Фехнера предсказывает, что различение двух стимулов зависит от их “соотношения сил”, а не разности. Действительно, гипотеза 3 (выбор детерминирован отношением числа “кудахтаний” в сопоставляемых стимулах) объясняет 84,4% дисперсии, P < 0,0005; рис. 1C и таблица S1 (Akre et al., 2011).
Удлинение сигналов в ходе полового отбора ограничено сверху когнитивными способностями самок выбрать “лучшего”, хотя изначально он “запускается” их предпочтением криков с большим числом “кудахтаний”. Слыша соперника, самцы удлиняют крики, прибавляя ещё “кудахтанья”, по одному за раз. Чем длиннее крики обоих, тем в силу закона Вебера — Фехнера труднее сравнить их, чтобы произвести выбор — и самкам, и хищникам. Тем более это верно в случае хора из множества особей (Akre et al., 2011).
Другой возможный ограничитель усложнения сигналов — пресс хищничества листоносов: чем длинней крик, тем легче лоцировать местонахождение жертвы. Предпочтение ими более сложных криков уже было известно, но Akre et al., 2011 впервые исследовали их предпочтения при дихотомическом выборе между криками с разным числом “кудахтаний”, звучащим с противоположных концов вольеры. “Выбором” полагали подлëт зверька к одному из источников звука на дистанцию <1 м. Листоносам для сравнения предлагали следующие пары криков (цифры — число “кудахтаний” после “скуления”): 0 vs 1, 0 vs 2, 0 vs 3, 1 vs 2, 1 vs 3, 1 vs 4, 1 vs 5, 1 vs 6, 1 vs 10, 2 vs 3 и 2 vs 4 (всего сделано 219 выборов 26 зверьками).
Для объяснения дисперсии выборов хищника использовали эти же 3 гипотезы. Как в случае с выбором лягушачьими самками, состоятельна только 3я, выбор по соотношению числа “кудахтаний” в сравниваемых криках (R2 = 0,739, P = 0,0007, рис. 1С, таблица S1). Объяснительная сила первых двух гипотез (выбор на основе суммы звуковой стимуляции и по различию числа “кудахтаний” ) слишком низка, R2 = 0,118, рис. 1А и R2 = 0,083, рис. 1В. Следовательно, предпочтения хищников управляются теми же правилами, что у самок, ограничивая удлинение сигналов половым отбором.
Действительно, в городах, особенно на освещённых участках, пресс хищников исчезает, листоносы их сторонятся. Успешно освоившие их тунгарские лягушки “поют” значимо чаще, чем негородские, и значимо больше “квохчут” (Halfwerk et al., 2019). Авторы сравнили вокализацию самцов и предпочтения самок из 11 городских и 11 лесных мест по обе стороны Панамского канала и по обоим берегам р. Chagres. Самки обоих популяций предпочитают песню самцов-горожан; переселение лягушек из нескольких городских локаций в лесные упрощало их песню на новом месте и уменьшало песенную продукцию (видимо, действовал риск гибели). Однако “лесные” самцы, переселённые в города, песню не усложняли: видимо, урбанизация уже наследственно увеличила сложность песен лягушек, освоивших город (Halfwerk et al., 2019, см. также рис.2-4).
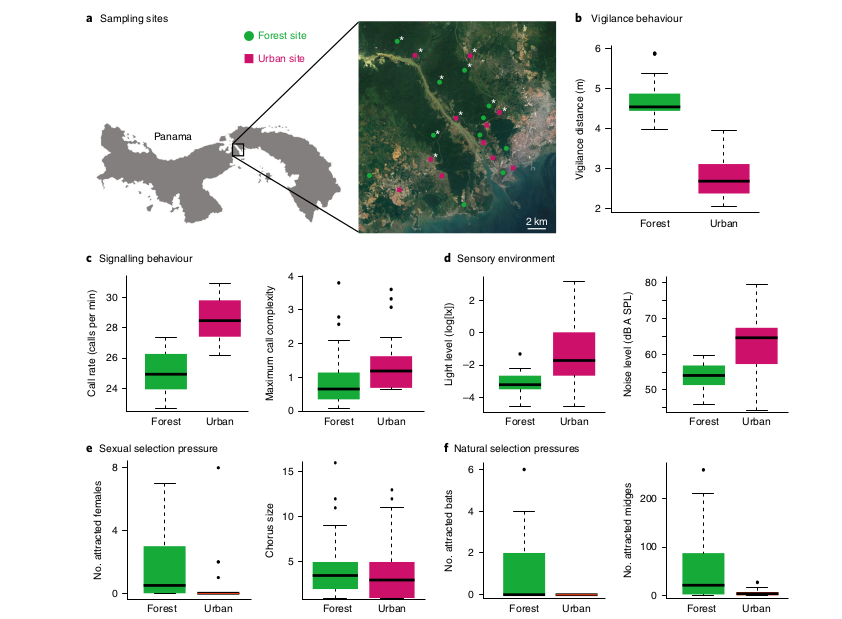 Рисунок 2. Разница в вокальной активности и давлении естественного отбора на “городских” vs “лесных” тунгарских лягушек.
Рисунок 2. Разница в вокальной активности и давлении естественного отбора на “городских” vs “лесных” тунгарских лягушек.
Обозначения. а. 22 лесные и городские локации, использованные в анализе. Белыми звездочки — популяции, использованные в опытах по переселению и для записи вокализаций в опытах по выбору самок. б, в — Различия в вокальной активности «городских» и «лесных» самцов тунгарской лягушки (малиновые vs зелёные столбики). К первым легче приблизиться: ближе подпускают, ниже дистанция (в м), на которой они настораживаются (b, n = 83). Они же издают больше криков/мин (c, n = 93) и эти крики сложнее (c, n = 98), чем у “лесных”. d–f, Различия селективного пресса на “городских” vs “лесных” самцов. d. Городские биотопы лягушек сильнее зашумлены (дБ, справа) и лучше освещены (лк, слева), чем природные (n = 100). e. При проигрывании криков большая интенсивность и сложность вокализаций “городских” лягушек в одноименных биотопах привлекает численно меньше самок (слева, n = 43), чем в лесных биотопах, при сравнимом размере хора кричащих самцов (справа, n = 98), т.е. между “городскими” самцами интенсивней конкуренция за самок и выше давление полового отбора. f. В городских локациях уровень хищничества листоносов (слева, показано число зверьков, привлечённых проигрыванием крика самцов) и паразитизма кровососущих двукрылых (справа, показано число привлечённых) значимо ниже сравнительно с лесными (n = 44).
Примечание. Диаграммы показывает медиану измеренного параметра, первый и третий квартили, 1,5–кратный межквартильный диапазон для модельных оценок (b,c) или исходных данных (d-f).
 Рисунок 3. Самки предпочитают крики “городских” самцов в условиях выбора между двумя динамиками, из которых транслировали брачный крик “городских” (спектрограмма справа) либо “лесных” самцов (слева).
Рисунок 3. Самки предпочитают крики “городских” самцов в условиях выбора между двумя динамиками, из которых транслировали брачный крик “городских” (спектрограмма справа) либо “лесных” самцов (слева).
Самок держали под воронкой на равной дистанции от обоих динамиков и выпустили после 2 м их звучания; обратите внимания на большее число “квохтаний” в криках справа (в среднем на 0,8), их выбрало в общей сложности 30 из 40 протестированных самок.
 Рисунок 4. “Лесные” самцы, перемещённые в городскую локацию, не усложняют брачного крика. Показан результат опытов по переселению самцов между “городскими” и “лесными” локациями (его дизайн а). b. Те и другие за несколько дней “подстраивают” к новой среде интенсивность вокализации (криков в мин): “лесные” в городских биотопах увеличивают, “городские” в лесных понижают. c. “Городские” в лесных местообитаниях с большим риском хищничества снижают среднюю сложность крика, однако “лесные” самцы в городских биотопах не увеличивают её. Представлены данные регистрации криков в начале вокальной активности переселенцев (n = 16 мезокосмов, 112 самцов); данные для пика её интенсивности показывает схожие закономерности. NS – различия незначимы.
Рисунок 4. “Лесные” самцы, перемещённые в городскую локацию, не усложняют брачного крика. Показан результат опытов по переселению самцов между “городскими” и “лесными” локациями (его дизайн а). b. Те и другие за несколько дней “подстраивают” к новой среде интенсивность вокализации (криков в мин): “лесные” в городских биотопах увеличивают, “городские” в лесных понижают. c. “Городские” в лесных местообитаниях с большим риском хищничества снижают среднюю сложность крика, однако “лесные” самцы в городских биотопах не увеличивают её. Представлены данные регистрации криков в начале вокальной активности переселенцев (n = 16 мезокосмов, 112 самцов); данные для пика её интенсивности показывает схожие закономерности. NS – различия незначимы.
Самки тунгарских лягушек также предпочитали «скуление» с низкочастотным «квохтаньем» высокочастотному; низкочастотное «скуление» высокочастотному; конспецифическое «скуление» гомологичным крикам других видов того же рода. Одновременно они хуже реагировали на крики голодных самцов (Page, Bernal, 2006; Kyle, Ryan, 2023).
Выучивая крики лягушек, листоносы распознают их по акустической форме
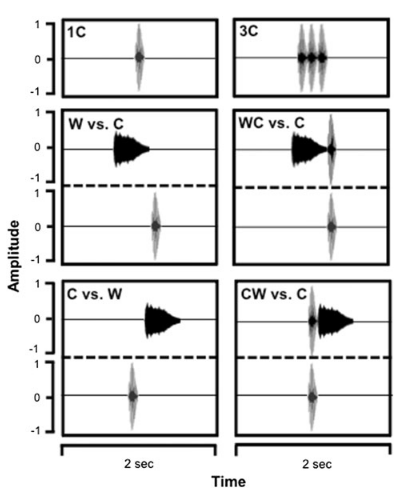
Имея одни предпочтения с лягушачьими самками, листоносы, однако, по сигналам самцов ориентируются совершенно иначе — приближаются и при отдельных проигрываниях «квохтанья»; при проигрывании его и «скуления» в разных местах предпочитают «скуление»; чувствительны к следованию этих двух компонентов во времени (Jones et al., 2013, рис.5).
Рисунок 5. Предпочтения листоносов при проигрывании лягушачьих сигналов разной структуры (верхний рисунок, показаны их спектрограммы): а. Одиночное “кудахтанье”, с, единичный стимул. b. То же самое, 3 “кудахтанья”; с. Выбор между двумя стимулами, единичное “скуление”, w, vs единичное с; d. Сложный сигнал w+c vs c; e. C vs w. f. c+w vs w. Нижний рисунок — интенсивность реакции листоносов, средняя ± SE ответов летучей мыши на каждый из стимулов. Из: Jones et al., 2013.
Помимо тунгарской лягушки, листонос хищничает и на других видах, всего до 15: фактически это разновидность «обмана в коммуникации». Реакция лягушек на «свои» брачные крики — инстинкт, тогда как летучие мыши выучивают вокализации жертв, отделяя съедобные виды от ядовитых: здесь виден параллелизм инстинктивных и выученных форм поведения, повсеместный среди позвоночных.
При проигрывании криков тех и других молодые летучие мыли устойчиво предпочитают более крупных жертв (видимо, это врождённо), но не различают их по съедобности, сближаясь с динамиком, проигрывающим крики токсичных видов; взрослые их игнорируют (Logan S. James et al., 2025).
У листоносов вообще отличная память: раз возникнув, реакция на условный стимул, связанный с пищей, возобновилась с одного предъявления через 4,2 года (Dixon et al., 2022). Листоносов отлавливали в 2010–2018 гг. в национальном парке “Соберания” (Панама). Они жили в вольере и обучались летать за кормом к динамику, проигрывавшему брачные крики лягушек, затем их меняли на звук одного из двух рингтонов мобильника. Прилетавшие и на этот сигнал зверьки получали вознаграждение, и быстро выучились связывать с пищей любой рингтон (условный стимул). Дальше задачу им усложнили: подкрепляли пищей прилёт после проигрывания одного из двух “правильных” рингтонов, но не подкрепляли прилёт на двух других “неправильных”.
После этого Диксон с соавторами провели дополнительное обучение. Листоносам давали корм, когда они прилетали к динамику в ответ на воспроизведение одного из двух правильных рингтонов. При воспроизведении трех других рингтонов подопытные награды не получали. Всего 49 листоносов выучились реагировать на “пищевые” звуки и игнорировать “пустые”; дальше их метили и выпускали на волю. В 2013–2016 гг. 8 из 49 зверьков поймали повторно и протестировали на память о 2 “пищевых” звуках из 5, т. е. c временным разрывом от 356 до 1531 дней. Опыты ставили в 3х вариантах: проигрывали звук, бывший “пищевым” до выпуска, его приглушенный вариант, использовавшийся при обучении, но но не подкреплявшийся пищей; контрольный звук, непохожий на эти два.
Для сравнения те же опыты ставили с 17 не обучавшимися листоносами “только что из лесу”. Им проигрывали оба “пищевых” звука, приглушённый и контрольный рингтоны. Все 8 обученных зверьков помнили связанные с едой звуки даже несмотря на разрыв в несколько лет: подлетали к динамику, откуда они звучали, 6 пробовали его атаковать. Из 17 “диких” зверьков заинтересовался ими только один. “Пищевые” звуки и приглушённые варианты (! т.е. выучивается акустическая форма сигнала, а не эмоция, рожденная его звучанием и/или связью с пищей в мозгу) интересовали эту восьмёрку летучих мышей значимо чаще, чем контрольные стимулы (p=0,001), “дикие” звери реагировали неизбирательно. Авторы не нашли забывания “пищевых” звуков, листоносы, дольше пробывшие на свободе, пищевой звук вспоминают не хуже.
Возможность вспомнить раз выученное 4,2 года спустя делает долговременную память бахромчатогубых листоносов сравнимой с таковой врановых птиц и низших приматов. Видимо, она позволяет зверькам помнить голоса редких видов съедобных лягушек, или появляющихся на короткий сезон (Dixon et al., 2022).
Источник N+1
Самое важное здесь: выучивая крики лягушек (или любые другие звуки) в качестве пищевого сигнала, листоносы распознают их и отличают от прочих, непищевых, также по акустической форме, как и лягушки, реагирующие на них инстинктивно, при помощи совсем по другому устроенных мозга и слухового анализатора. Это ещё один аспект параллелизма выученного и инстинктивного поведения: в обоих случаях успешность реакции недостижима без распознавания образов, следовательно, без “выдачи” лоцируемых сигналов так, чтобы они обладали типологически определённой формой, в данном случае акустической, в других же ольфакторной или визуальной.
Ритуализованность демонстраций и выедание хищниками
Анализ разных категорий демонстраций позвоночных (ухаживания, угрозы, предупреждения об опасности и пр.) обнаруживает позитивную связь между степенью ритуализации поведения и интенсивностью демонстрирования, с одной стороны, и селективной смертностью со стрессом, с другой. Скажем, текущий успех в спариваниях самцов тетерева Lyrurus tetrix чётко коррелирует с центральным положением участка на току, суммарный успех спариваний за жизнь – со скоростью перемещения охраняемой территории с периферии тока в центр за несколько лет, пока самец демонстрирует на каком-то току; обычно он не меняется на протяжении его жизни. Поведенческий признак, лучше всего коррелирующий с успехом спаривания самца — частота присутствия на току в течение всего года и/или частота демонстрации «лиры» (выгнутых украшающих перьев хвоста) непосредственно при токовании на своей территории (Rintamäki et al., 2000, 2001).
Развитость «лиры» растёт с возрастом самца: украшающие перья удлиняются и сильней изгибаются наружу. Именно они, в сочетании с экстравагантными демонстрациями самцов на своих территориях (агонистическими, структурированными в «параллельные дуэли» и «дуэли кивания» или собственно брачными) детерминируют повышенный риск гибели от хищника. Скажем, под гнездом беркута (Aquila chrysaetos) в Калининской области в поедях преобладали остатки глухаря Tetrao urogallus и тетерева. У того и другого вида риск погибнуть в когтях беркута повышен именно у токующих самцов (в 1,5-3 раза). Риск гибели самца тетерева почти вдвое выше, чем самца глухаря — остатки первых в поедях составляют 80% особей соответствующего вида, вторых — 60% См. Авданин В.О., Карху А.А., 1998. Беркут в Центрально-Лесном биосферном заповеднике // Редкие виды птиц Нечернозёмного центра России. Мат-лы II Совещания «Редкие птицы Европейского Центра России». М.: изд-во МПГУ. С.145-149.
Как известно, система токов у тетерева развита значительно сильней и более специализирована, чем у глухаря. Глухарям свойственен так называемый «разреженный ток», где самцы конкурируют непосредственно за самок, а не за возможность улучшить «позицию» собственной территории внутри тока. У тетерева и других «настоящих» токовых видов интенсивные демонстрации и столкновения самцов друг с другом происходят сугубо в территориальной сфере. Группы самок, посещающие ток, привлекаются не непосредственно демонстрациями самца, а центральной «позицией» его территории в анизотропном пространстве токовища.

Демонстрирующий тетерев, Присурский зап-к.
Поэтому у тетеревов сильней проявляется половой диморфизм, лучше развиты брачные украшения2; в сравнении с глухарями, у него более ритуализованы и стереотипны территориальные (а не брачные) демонстрации, а их регулярное исполнение в период пребывания на току – главнейшее условие успеха самца. Соответственно успешность самца в спариваниях (относительно других самцов токовища) чётко коррелирует с возрастом и степенью развития «лиры», которая в этом случае оказывается и «честным» сигналом, и гандикапом (Rintamäki et al., 2001).
Однако корреляция репродуктивного успеха с развитием «брачных украшений» отмечена только для одной категории самцов, условно говоря, выигрывающих конфликты. Это их территории имеют тенденцию направленно перемещаться с периферии к центру тока за время пребывания там самца, именно они (что наиболее важно) в течение сезона устойчиво успешны в разрешении территориальных конфликтов – на уровне «более центральных самцов» того района, куда перемещается их участок. Оба критерия показывают способность данных индивидов устойчиво увеличивать собственный социальный статус, инициируя конфликты с соседями и выигрывая их, то есть эффективность социальной коммуникации, одно из следствий которой — репродуктивный успех (Rintamäki et al., 2001).
У остальных же самцов, проигрывающих конфликты, такого не получается, несмотря на сопоставимую развитость «лиры». Из-за неуспешности демонстрирования их территории «задерживаются в продвижении» к центру тока, что отрицательно сказывается на привлекательности для самок (= элиминация социальным отбором), или они просто вылавливаются хищниками. То есть большая развитость брачных украшений (делающая демонстратора избыточно уязвимым) есть не условие, а предпосылка успеха, реализуемая только в успешной коммуникации, то есть после эффективного «считывания» информации, передаваемой сигналами, и вследствие адекватной реализации информации в поведении.

Территориальный конфликт тетеревов на току. Присурский зап-к.
Отбор на криптичность демонстраций усиливает их сигнальный эффект
Для защиты от хищников тунгарская и другие лягушки отнюдь не отказываются от “пения”, но модифицируют его ритмику в сторону уменьшения риска. Например, запевают хором: возникающая слуховая иллюзия, следствие эффекта предварения, мешает лоцировать местонахождение каждого отдельного самца: так делают курносые лягушки Smilisca sila, но не тунгарские.
Это же верно для других видов: сравнительно с девятииглой колюшкой Pungitius pubgitius малые южные колюшки P.platygaster живут в условиях постоянно высокой угрозы нападения хищных рыб и птиц. Кроме хищных рыб (окунь, судак, щука, бычки Neogobius), это рыбоядные рептилии (водяные ужи, болотные черепахи) и многочисленные птицы-ихтиофаги (цапли, чайки и крачки). Наибольший риск гибели — во время нереста, особенно при исполнении «зигзагообразного танца». «Зигзаги» хорошо заметны даже в густых зарослях, где нерестится P.pungitius, а тем более в открытых нерестовых местообитаниях P.platygaster; об этой и других брачных демонстрациях обеих форм см.”Работа релизеров в коммуникации животных: хороший стимул — плохой сигнал, и наоборот”.
Брачные демонстрации южной колюшки криптичней гомологичных телодвижений, но одновременно обладают значимо большим сигнальным эффектом. Первое достигается меньшей экспрессией и экстравагантностью «скачков» из стороны в сторону, образующих «танец». У P.platygaster существенно ниже дистанция перемещения рыбки за один «скачок» и число скачков в танце: во время него самец движется лишь вокруг самки и не удаляется от неё настолько далеко, как самец девятииглой колюшки. Всё это уменьшает заметность самца малой южной колюшки, окраска колючек которого ещё и делает его незаметным хищникам, находящимся спереди и сбоку от рыбки.
Однако в условиях повышенного риска хищничества её демонстрации не просто функциональны (устойчиво сохраняют ориентацию самки на самца, направленно доводя взаимодействие до нереста), но и намного эффективней как управляющие им сигналы, чем более “яркие” гомологичные демонстрации девятииглой колюшки.
В первом случае среднее число остановок самки, ведомой самцом к гнезду, почти в 5 раз меньше, чем во втором (0,5 у P.platygaster и 2,31 у P.pungitius, n=22 в обоих случаях). Каждая «остановка» создаёт риск срыва ухаживания и опасность незавершения нереста для самца. Наконец, в опытах по скрещиванию самцов P.platygaster с самками P.pungitius 3 из 8 предложенных самок оказались незрелыми (они отказались нереститься с самцами своей формы), но самцам малой южной колюшки удалось не только подвести таких самок в гнездо, но побудить проникнуть в него несколько раз подряд. В нересте самих P.pungitius такое случается крайне редко, не чаще 1 раза на 50 нерестов (Гомелюк, 1979).
Наконец, у малой южной колюшки роль демонстраций как ключевых раздражителей сильно снижена. В репертуаре этого вида отсутствует «твистинг», который непосредственно стимулирует самку в период её ведения к гнезду (он стимулирует к продолжению следования лишь половозрелых самок, неполовозрелые в ответ на него отплывают прочь). P.platygaster для этого достаточно «зигзагообразного танца», который уже в начале взаимодействия отделяет рецептивных самок без непосредственного воздействия на них. Необходимостью прямой стимуляции самки вызваны все без исключения «сбои» в процессе ведения самцом P.pungitius самки P.platygaster к гнезду. Если самка отстаёт, она нуждается в повторении «зигзагообразного танца», но самец P.pungitius в этом случае склонен воспроизводить твистинг снова и снова (Гомелюк, 1979).
Риск нападения хищника с точки зрения коммуникации — просто “помеха” в канале связей, подрывающая устойчивость приёма-передачи сигналов и снижающая эффективность общения, также как городской шум, вой ветра для морских птиц в “ревущих сороковых” и “воющих пятидесятых” широтах и другие подобные факторы. В исследованиях механизмов коммуникации позвоночных важно, что в ответ на интенсификацию тех и других “помех” участники коммуникации вовсе не прекращают её ради спасения жизни и/или не понижают “сигнальность” демонстраций (оставляя только воздействие их как стимулов). Напротив, они увеличивают её, предпринимая специальные усилия по сохранению в неизменности сигнальных инвариантов; наряду с большей стереотипностью демонстрирования, описанной выше, это например, повышение частоты звучания песен и других вокализаций у урбанизированных видов певчих птиц, делающее их устойчивей к городскому шуму. Из-за последнего городские птицы также поют громче.
И наоборот, снижение зашумлённости — скажем, из-за карантина во время пандемии COVID-19 — вновь понижает как громкость, так и частоту пения. Сдвиги звучания в условиях повышения шума в канале связи и/или при демонстрировании в условиях опасности показывают значимость для эффективной коммуникации «морфологии поведения», описывающей форму сигнала, и незначимость количественных, статистических характеристик, связанных с характером стимуляции. Вышеописанные действия особей нельзя объяснить иначе, как необходимостью однозначного распознавания специфической формы сигнала. Независимо от того, как меняется мотивационное состояние демонстратора и реципиента за время взаимодействия между ними, неточное распознавание формы сигнала не скорректируешь бόльшим воздействием на партнёра, придётся усиливать «знаковость» демонстраций.
Примечания
1 Самок (и хищников) ещё привлекает раздувающийся пузырь резонатора самца.
2Брачные украшения – частный случай эксцессивных (рекламных) структур (англ. advertising traits). Специфические образования или окрасочные элементы, «рекламируемые» строго определёнными демонстрациями. Иногда это настоящие морфоструктуры — удлинённые перья, цветовые пятна, горловые мешки, выросты, гребни и т.п.. Иногда это лишь узнаваемый образ, создаваемый демонстрацией на определённое время, необходимое чтобы сигнал подействовал, вроде «психоделической улыбки» чудной райской птицы Lophorina superba.
Рекламные структуры развиваются специально для предъявления определенным партнёрам в рамках взаимодействий определенного типа. Это доказывается строгой сопряжённостью филогенетического развития демонстрации и структуры, предъявляемой демонстрацией, что легко прослеживается при сравнении близких видов. Например, у желтошапочного лианового манакина Heterocercus flavivertex есть уникальная демонстрация трепетания хвоста, не встречающаяся у других представителей рода. Все остальные демонстрации, такие как демонстративный полёт на фоне неба и пять дифференцированных вокализаций, имеют точных гомологов у других видов рода. Именно специфика движений животного при демонстрации, предъявляющей необычную форму хвоста, объясняет развитие данной эксцессивной структуры у данного вида, а не наоборот (Prum et al., 1996).