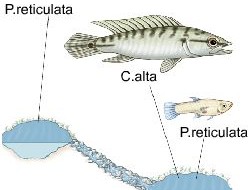
Эволюция гуппи в местообитаниях с низким (выше водопада) и высоким риском хищничества (ниже водопада)
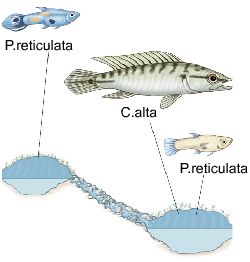
Реки Тринидада, стекающие с Северной горной цепи, оказываются чрезвычайно удобны для исследования этой самой эволюции. Во всех реках от верховий до низовий живут дикие гуппи, на которых охотятся самые разные хищные рыбы – в общем, все те, что обитают на острове. В целом в каждой из речек в низовьях разных видов хищников много (разные виды цихлид, харацинид и др.), а чем выше – тем меньше, и в верховьях обитает только Rivulus hartii. Причём, что самое главное, на счастье учёных каждая речка в нескольких разных местах прорезана водопадами, через которые хищники сами распространиться не могут. Водопады мешают распространяться из низовий в верховья и всем другим видам рыб тоже, поэтому разнообразие их видов быстро убывает в данном направлении, ну а гуппи живут везде.
«Удивительно, но они могут селиться в ручье над водопадом. При наступлении сезона дождей реки обычно поднимаются, сокращая высоту водной стены. В это время гуппи прыгают через получившиеся барьеры и захватывают бассейны выше водопадов. Однако не все виды рыб способны перепрыгивать на такие большие расстояния, поэтому они обнаруживаются в ручьях в основании водопада. Одним из видов, распространение которого ограничивается таким образом, является щукоподобная цихлида Crenicichla alta».
Источник aquavitropro (здесь и далее в кавычках)
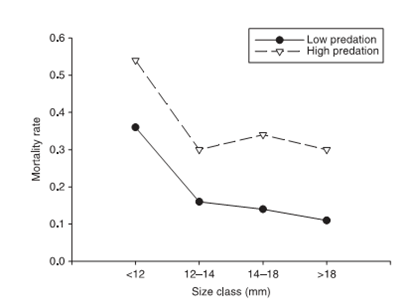
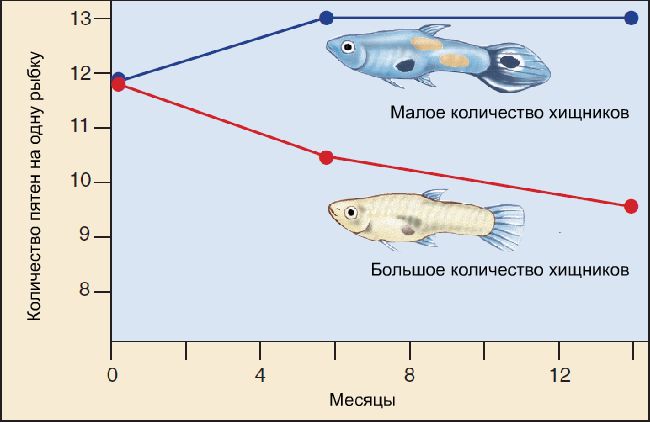
Рисунок 1. Сравнение уровней смертности гуппи в местообитаниях с высоким (далее А) и низким риском хищничества (далее Б). Данные по 7 разным точкам А и 7 – Б из 3-х речных бассейнов. Риск гибели рассчитан по данным мечения с повторным отловом через 12 дней.
Что важно: изолированность этих отрезков речного русла водопадами гарантирует, что число хищников не изменится в результате расселения последних.
Это позволяет поставить эксперимент, пересадив гуппи из местообитаний с высоким риском хищничества, давно уже приспособившихся к этому прессу, в местообитания с низким риском. Естественно, когда гуппей из популяции с высоким риском хищничества пересаживали в среду с низким риском, то в соответствующем отрезке речного русла вылавливали всех рыб, кроме ривулусов.
Цель такой пересадки — посмотреть, какие изменения эволюционного характера вызовет снятие пресса хищников, и вызовет ли. При положительном результате опытов – если существенное снятие пресса хищничества помимо изменений в биологии/поведении (в принципе обратимых), вызовет элементарные эволюционные явления, то есть направленные устойчивые сдвиги морфологии, популяционной структуры и т.п., можно посмотреть, насколько они необратимы. Для этого из «пересаженной» популяции делали отводок в местообитание с высоким риском хищничества, и смотрели, смогут ли они приспособиться заново?
Эти исследования были начаты переселениями рыбок из местообитаний А в Б, проведёнными в 1957 г. Карелом Хаскинсом, дальше их широко развернул Эндлер в 1970-х гг. (Endler, 1978, 1980), то есть уже прошло предостаточно поколений. Авторы настоящей работы N.Reznick, C.K.Ghalambor и K.Crooks (2007) подытоживают их результаты: они работают с популяциями, пересаженными задолго до них, и помимо этого собственного исследования, пользуются результатами предшественников, работавших с теми же экспериментальными популяциями.
Помимо очевидного теоретического интереса, эти исследования важны и практически. Дело в том, что на протяжении 19-20 вв. очень многие территории дикой природы в развитых странах, хотя и сохраняют в целом девственный облик, но теряют виды крупных хищников, занимающих самые верхние этажи экологической пирамиды (англ. top predators: волки, медведи, рыси, крупные орлы, особенно в тропиках и т.п.). Часто это ведёт к негативным последствиям в контролируемых ими популяциях жертв – вспышку размножения численности, перенаселение, болезни и гибель, как у оленей на плато Кайбаб, иногда нет, но так или иначе очень многие популяции видов-жертв несколько поколений провели совсем без хищников и как-то приспособились к этим обстоятельствам. А вот сейчас важной частью природоохранных мероприятий является возвращение крупных хищников на «вершину» экологической пирамиды, чтобы она не осталась незавершённой.
И вот когда жертва, отвыкшая от соответствующего пресса и контроля, вновь вступает во взаимодействие с хищником, она несёт большие потери и последствия оказываются вполне трагическими. Иными словами, хищники воздействуют на жертв не только в экологических, но и в эволюционных масштабах времени, пресс хищничества, его увеличение или снятие регулирует эволюцию жертв. Если последние на несколько поколений выведены из-под контроля хищников, то не просто отдельные особи «отвыкают бояться», но вся популяция эволюционирует в сторону, обеспечивающую максимум уязвимости при повторном контакте.
Чтобы уменьшить груз негативных последствий от реинтродукции хищников для популяций их бывших жертв (многие из которых также относятся к охраняемым видам), надо понять не только экологические, но и эволюционные последствия отсутствия хищника.
Обычные объяснения возрастающей чувствительности к хищнику у жертв, которые в силу исторических обстоятельств лишились своих традиционных хищников, а потом, через десятки или сотни лет, снова вошли с ними в контакт, обычно концентрируется на потере жертвой механизмов защиты от хищника и не учитывает селективных последствий. Последние связаны не только с отрицательным подтверждением поговорки «на то и щука в море, чтоб карась не дремал», в том смысле что вернувшие «щуки» легко ловят подрёмывающих «карасей», сколько с тем что изъятие «щук» на сколько-нибудь существенное время запускает эволюцию «карасей» в сторону, увеличивающую их чувствительность к «щукам». Те быстрые изменения, что фиксируются у гуппи в тех отрезках речных систем, где они были свободны от хищников — это типичные элементарные эволюционные явления по определению последних.
Отсюда существенен ответ на вопрос: запускает ли снятие соответствующего контроля эволюционирование жертвы в сторону такой степени уязвимости, которую (при повторном контакте с хищником) особи измененной популяции не могут компенсировать за счёт поведенческой пластичности или обычной степени вариации видовой биологии, и несут неоправданные потери или нет? Эту простую мысль об эволюционных последствиях изъятия хищников часто игнорируют, и соответствующие эффекты плохо изучены, и исследование «пересаженных» популяций гуппи может пролить свет на это.
Понятно, что эта постановка опыта со «снятием пресса хищников» путём пересадки гуппи из А в Б не вполне чистая. Кто-то из тех видов рыб, что элиминировались при отлове, связанном с пересадкой, мог быть пищей для гуппи, кто-то конкурировал с ними за пищу (тем более что при снятии пресса хищников эти конкуренты тоже бы увеличили свою численность). Для обоснования того, что различия, накопившиеся в экспериментальных популяциях гуппи после пересадки в А по сравнению с исходными популяциями в Б (рисунок 2; видно, что такие различия возникают и накаливаются очень быстро) авторы используют 2 типа аргументации.
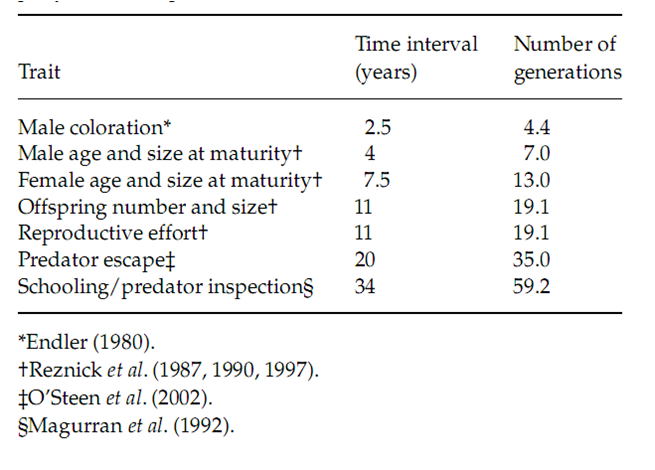
Рисунок 2. «Экспериментальная эволюция» пересаженных популяций гуппи под влиянием снятия пресса хищничества: изменившиеся характеристики и скорость изменений.
Показано количество лет и число поколений, необходимых для появления значимых изменений в пересаженных популяциях Б по сравнению с исходными местообитаниями А, откуда они были взяты. Для измерения этих параметров гуппи из экспериментальной популяции, находящихся в процессе изменения, отлавливали на разных этапах последнего и содержали в контролируемых лабораторных условиях; соответствующие характеристики мерили у второго поколения особей, родившихся уже в лаборатории. В местообитаниях Б гуппи дают 1.74 поколения в год.
Во-первых, сравнивают изменения рис.2 с изменениями в тех природных популяциях (обычно разных видов наземных позвоночных), освободившихся от пресса хищников вследствие вымирания последних; если окажется, что соответствующие сдвиги однотипны, тем более происходящие в столь разных группах, то точно эо следствия одной причины. Во-вторых, они исследуют, что происходит с уже изменившимися популяциями рисунка 2, когда хищники вновь возвращаются, точней, могут ли эти рыбки вновь колонизировать свои исходные местообитания?
Авторы считают (и я тут с ними согласен), что анализ таких эпизодов направленного отбора таки даёт возможность получить надёжные цифры скорости эволюционных изменений. Гипотеза о том, что изменения рис.2 возникли в ходе стохастических процессов, под действием дрейфа генов или принципа основателя, отвергается потому что они происходят одинаково в разных пересаженных популяциях, тем более что аналогичные изменения фиксируются при снятии пресса хищничества в других группах.
Забавно, однако, что сравнение генофондов пересаженной и исходной популяции (проведённое, правда, лишь в одном из мест пересадки, и сравнение ограниченное – лишь по разнообразию некоторых аллозимов) показывает что первое возникло из второго в ходе стохастических процессов типа дрейфа. Во всяком случае, если признаки популяционной структуры и фенотипы особей в пересаженной популяции на снятие пресса хищничества дают чёткую картину направленных изменений (рис.2), то относительно изменений генофондов картина как минимум неясная.
[Я же думаю – вообще там пока изменений нет или они обусловлены дрейфом. Почему? Потому что во многих случаях уже показано, что морфофизиологическое расхождение форм под действием отбора, адаптирующего их к разным местообитаниям, или же расхождение двух популяционных систем в процессе видообразования, когда они становятся отдельными видами, отнюдь не сопровождается изменениями генофондов. При том что морфотипы или параметры популяционной биологии в этих случаях сильно дивергируют, генный пул остаётся общим; это случаи отделения городских чёрных дроздов от лесных, дифференциации серой и чёрной вороны и т.п. см. здесь, п.3.
То есть во многих случаях эволюционной дивергенции, связанной с процессами видообразования ли, адаптации ли к новой среде обитания, генетические изменения сильно отстают от фенотипических сдвигов. Фактически то разделение фенотипов и\или паттернов популяционной структуры, которое необходимо в соответствующих эволюционных процессов, уже полностью завершается тогда, когда генный пул разделившихся форм ещё общий.
А это, мне кажется, веский камешек в огород СТЭ, которую так замечательно защищал Саша Кузнецов на последнем семинаре. {не говоря уж о подходе Докинза-Уилсона, предполагающего отбор генов, а не фенотипов, и тем более не отношений, видоспецифическим образом связывающих индивидов внутри популяции, хотя именно отношения регулируют перемещение, взаимодействие и воспроизводство фенотипов}. Ведь согласно СТЭ случаев, когда в фенотипическая дивергенция популяций в эволюционном процессе завершается в тот момент, когда расходение генных пулов фактически ещё не началось (т.е. все имеющиеся различия генофондов обусловлены дрейфом) в сколько-нибудь значимом количестве быть не должно.
А они есть, и их довольно много, при более тщательном подходе может вполне оказаться, что они в большинстве. Тогда если генетическая дивергенция форм по сравнению с дивергенцией морфологической начинается с сильным запозданием и фактически только тогда, когда эти формы уже дифференцированы эволюционным процессом (серая и чёрная вороны тут лучший пример), то понятно, что эти процессы есть «отдача» шишкинского преобразования онтогенеза в сторону большей устойчивости новой нормы, а не результат прямого отбора по соответствующим генам. См. также здесь, п.4 + ещё эмпирические примеры в пользу эпигенетической теории эволюции
Впрочем, всё вышесказанное – довод не только в пользу эпигенетической теории эволюции, но и в пользу милого мне варианта номогенеза, который
a) основывается на «морфологическом подходе» к популяционной структуре,
b) предполагает элементарным эволюционным явлением сдвиг паттерна отношений, связывающих индивидов в этой системе, а не сдвиг признаков морфотипа, и
c) следует из сортировки особей по потенциям вместо отбора фенотипов по признаком. См. PS отсюда.
Отбор лишь закрепляет результаты дифференциации, произведённой за счёт сортировки внутрипопуляционными механизмами – или, наоборот, устойчивость связи между разными внутрипопуляционными группами, поддерживаемой за счёт перетока нерезидентов. В.К.].
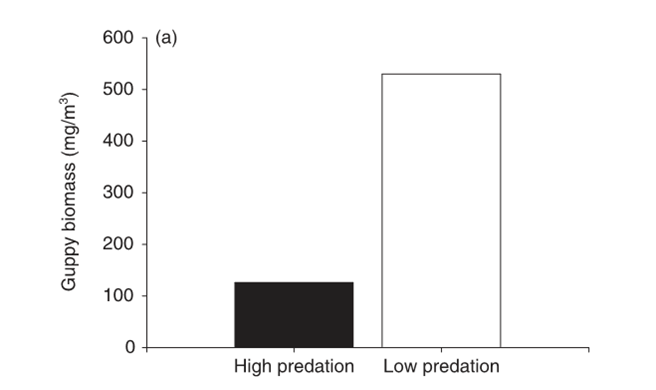
Вернёмся к гуппи. Сравнение экологии их популяций в местообитаниях А и Б показывает нам именно те эффекты высокого\низкого пресса хищничества, которые наблюдались у самых разнообразных видов в совершенно других местах (скажем, в наземных экосистемах). Скажем, в А плотность популяции и её биомасса в 4-5 раз меньше, чем в Б. Важно подчеркнуть, что большая биомасса гуппи в Б – следствие скорей большего размера рыбок, чем их большей численности; в А преобладают мелкие и быстроразмножающиеся особи, сравни распределения особей по размерным классам. Верхний размерный класс составлен только зрелыми самками, первые два – незрелыми индивидами, третий – зрелые самцы и впервые созревшие самки.
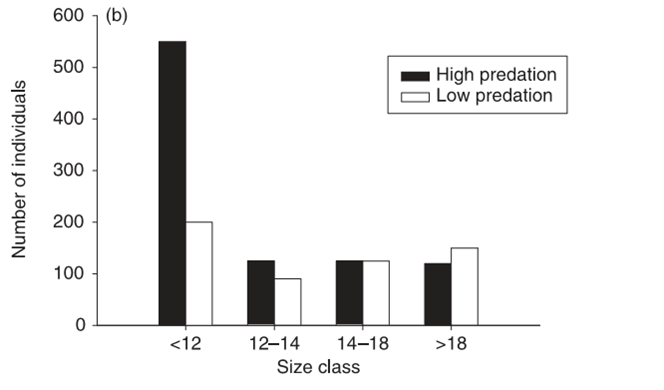
Возрастная структура гуппи в популяциях с высоким (тёмные столбцы) и низким риском хищничества (светлые). Ось Х — размерные классы, см., У — число индивидов данного размера
Также пресс хищничества влияет на скорость роста особей и сдвигает возрастную структуру. В Б скорость роста отдельных особей ниже (хотя они достигают большего размера), существенно снижены также уровни смертности и рождаемости по сравнению с А. Соответственно, в возрастной структуре популяции в А доминируют молодые особи, в Б распределение особей по возрастам однородное.
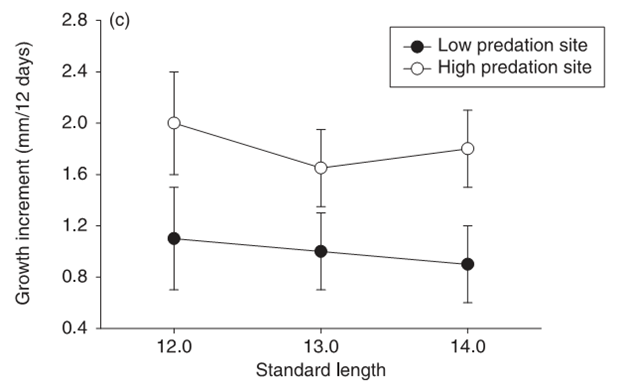
Скорость роста рыбок разного окончательного размера в популяциях с высоким и низким риском хищничества
И точно такие же изменения в популяционной плотности, возрастной структуре и скорости роста наблюдаются в «пересаженных» популяциях, то есть экспериментальная процедура вполне эквивалентна тому снятию пресса хищничества, который бывает в природе.
Далее, сильный пресс хищничества существенно видоизменяет биологию вида. Они создают давление отбора, дающее преимущество особям меньшего размера, созревающим раньше и способным размножаться при меньших линейных размерах.
Гуппи из А рождают больше (и более мелких) мальков в каждом помёте, а популяция в целом под воздействием хищников увеличивает долю ресурсов, направленную на рождение особей следующего поколения, по сравнению с долей, направленной на соматический рост, самосохранение, социальную активность и прочие нужды особей текущего поколения. См. рисунок 3а, б, в, г.

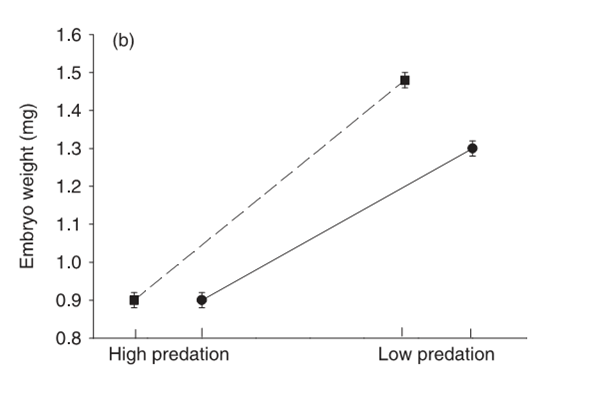
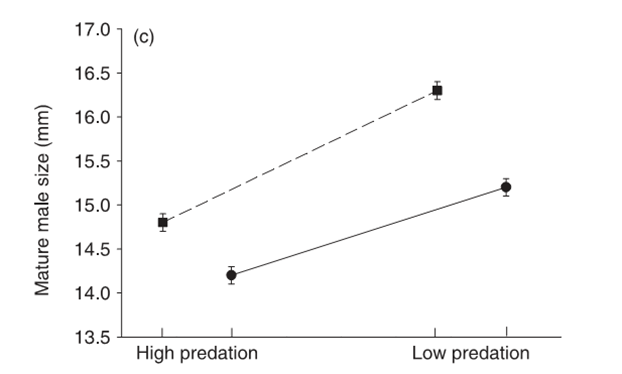
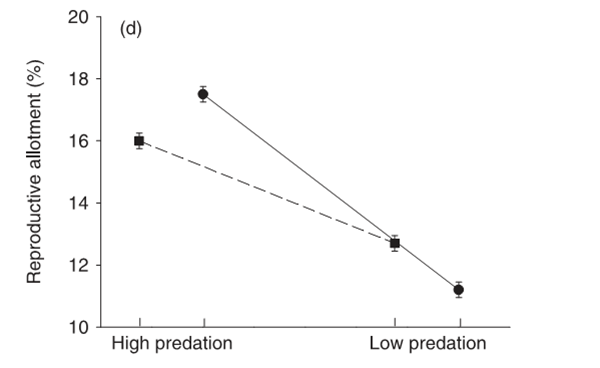 Обратите внимание на однотипность различий между местообитаниями А и Б, и однотипность изменений, наблюдающихся при переходе от первых ко вторым, хотя здесь использованы данные по разным речкам двух противоположных горных цепей острова.
Обратите внимание на однотипность различий между местообитаниями А и Б, и однотипность изменений, наблюдающихся при переходе от первых ко вторым, хотя здесь использованы данные по разным речкам двух противоположных горных цепей острова.
Соответственно, в экспериментальных популяциях, вышедших из-под пресса хищников, наблюдаются изменения в строго противоположную сторону. Рыбы становятся крупнее, медленнее растут, самцы делаются более ярко окрашенными, вообще эффект полового отбора начинает преобладать над эффектом элиминации хищниками, тогда как в исходных популяциях было наоборот. В местообитаниях А рыбки куда более способны к резкому броску с уплыванием прочь, который возникает рефлекторно в ответ на угрозу появления хищника. Fig.4 в статье показывает, что среднее и максимальное ускорение, развиваемое самками гуппи при броске прочь от хищника, значимо выше в местообитаниях А, чем Б. Важно подчеркнуть, что обе группы местообитаний объединяют данные по разным речкам, не не влияет на однотипность эффектов.
Walker et al. (2005) в опытах с хищниками показал, что при постоянном риске нападения хищника выживание особи непосредственно зависит от «быстрого старта». Далее, Magurran et al. (1992) что особи из местообитаний с высоким риском хищничества куда лучше обучаются внешним признакам, связанным с угрозой нападения, поэтому хищнику к ним труднее приблизиться для броска, чем к рыбкам из Б. Наконец, O’Steen et al. (2002) показал, что при искусственном сосуществовании с хищником мгновенная вероятность выживания особей из местообитаний А много выше, чем из Б.
Все перечисленные различия были зафиксированы в первой-второй лабораторной генерации потомков рыб, взятых из названных речных местообитаний, они устойчиво сохраняются в первых нескольких поколениях их лабораторных потомков, то есть можно предполагать генетическую основу изменений, вызванных отбором. Другое дело, что установить конкретную специфику генетических изменений не удаётся, что очень хорошо согласуется с ЭТЭ; правда, может быть, копали не так усердно, как если бы понимали всю теоретическую важность этого вопроса.
{И самое замечательное, зафиксированное направление эволюционного сдвига на уровне популяций – большая доля ресурсов вкладывается в размножение, в ущерб инвестированию в жизненные отправления особей этого поколения — прямо противоположно направлению аналогичного сдвига на уровне особей. Увеличение риска гибели от нападения хищника увеличивает уровень стресса, а вызванные им физиологические и поведенческие изменения сдвигают тот же трейд-офф в пользу преимущества самосохранения и обеспечения витальных потребностей (включая усиленное кормление и рост) перед участием в репродукции.
Тут нужно маленькое отступление. Сейчас становится постепенно понятным, что жизненные циклы самых разных видов позвоночных строятся и регулируются единым принципом трейд-оффа (или по-русски, адаптивного компромисса) между вкладом в воспроизводство следующего поколения и вкладом в удовлетворение собственных витальных потребностей, т.е. в себя любимого. Причём этот компромисс в каждом следующем сезоне размножения надо достигать заново, ориентируясь на сравнение сигналов из внешней среды, экологической и социальной, с собственным состоянием и «силами» животного, куда входят физические силы, уровень ресурсообеспеченности, уровень агрессивности, уровень брачного возбуждения, и уровень стресса.
Рост последнего сигнализирует о выходе интенсивности средовых воздействий за оптимальный уровень, о том что требуются напряжение и мобилизация сил, на которую готовы не все, а только лишь «сильные» и «успешные» особи. Сам вид воздействия тут не очень существенен – и увеличение риска хищничества, и рост напряжённости социальных контактов, и экстремальные условия внешней среды, погодные или кормовые, равно опосредуются увеличением концентрации гормонов стресса. Как это влияет на жизненные циклы особей, какие вызывает отклики в виде физиологических/поведенческих изменений, хорошо рассказано в обзорной статье Е.А.Новикова и М.П.Мошкина «Роль стресса в модификации поведенческих программ».}.
Первое предполагает активное участие в репродукции, высокие затраты как на само производство яиц и детёнышей, так и на те формы брачной активности (и шире, всей социальной активности, вроде занятия территорий, их охраны и рекламирования, поддержания определённого рода иерархии в группах и пр.), без которых размножиться не удаётся. Как я уже писал, самую «эгоистическую» потребность в максимизации итоговой приспособленности не удовлетворить в одиночку, надо взаимодействовать с другими индивидами, при этом укладывая собственную активность в видоспецифические формы демонстраций и укладывая поддерживаемые структуры отношений в видовую норму социальной организации. Выход первого и второго за пределы видовой нормы делает все вложенные усилия напрасными.
Первое, с одной стороны, предполагает значительный выигрыш. С другой, оно связано с существенно большим риском, ибо всякое активное участие в размножении и особенно в той социальной активности, без которой последнее невозможно и неэффективно, увеличивает риск (в том числе подверженность гибели от хищников) и снижает иммунитет, увеличивая подверженность болезням и стрессам. Подробней об этом см. здесь и здесь.
Второе же – выбор в пользу больших усилий в самосохранении, нежели в репродукции, означает отказ от выигрыша или существенно меньший выигрыш, ибо животное «пропускает ход», не участвуя в данном сезоне размножения или участвуя с существенно меньшей успешностью, чем «средние» особи в популяции. Зато эти особи избегают высоких затрат и высокого риска, и к следующему сезону размножения имеют шансы прийти в существенно лучшем состоянии, нежели индивиды, сделавшие выбор противоположного рода.
«На одном полюсе градиента «качества» (без определения, кто выше, кто ниже), особи, выигрывающие в социальной конкуренции: в каждый данный момент они готовы максимально развернуть агрессию или ухаживание, даже при паразитарных стрессах, когда другие особи вкладываются в иммунный ответ. Выигрывая в социальной конкуренции, они проигрывают в подверженности средовым стрессам – особенно в экологически неблагоприятные годы. На другом полюсе градиента «качества»: особи, устойчивые к энвиронментальному стрессу, но проигрывающие в социальной конкуренции: неблагоприятные изменения среды у них вызывают хороший иммунный ответ, они легко отказываются от социальной активности ради прекращения преследования доминанта, физиологического ответа на неблагоприятные изменения среды и т.п. См. 1, 2 и 3.» [Источник].
Как я уже говорил, выбор в пользу одной из возможностей (максимизация выигрыша или минимизация риска) каждый сезон размножения нужно совершать заново, или же достигать оптимального компромисса между ними, структурируя собственное поведение так, чтобы достигались обе возможности, но частично. Соответственно, акты совершения выбора всё сильнее дифференцируют особей в популяции. Условно говоря, особи «сильные», с высокой эффективностью коммуникации и/или с высоким уровнем ресурсообеспеченности выбирают активность, связанную с размножением в ущерб активности, связанной с самосохранением, особи «слабые», сильно стрессированные и/или плохо обеспеченные ресурсами – наоборот. Отсюда возникает существенная поливариантность онтогенезов особей в популяциях позвоночных.
Так или иначе, существенный рост риска хищничества увеличивает стрессированность особей и на уровне особей вроде бы даёт преимущества индивидам, выбирающим минимизацию риска в ущерб инвестициям в размножение. Однако когда мы анализируем изменения на уровне популяционной структуры, то видим прямо противоположное – рост инвестиций в воспроизводство при сокращении затрат на самоподдержание. То есть эволюционирующая популяция ведёт себя контринтуитивно, наблюдаемые сдвиги популяционной структуры в N поколениях не вытекают напрямую из тех предпочтений одних особей перед другими, которые устанавливаются отбором в каждом из этих N поколений, а зачастую и противоположны им.
Причём у рыб описаны 2 варианта эволюционных откликов на увеличение риска хищничества (видимо, исчерпывающих все принципиальные возможности). Первый такой, как у этих гуппи и, в общем, неинтересный для этолога. Это путь общей редукции структур, связанных с брачным поведением, особенно т.н. «брачных украшений», у гуппи это ослабление расцветки самцов, уменьшение экспрессии демонстраций и т.п. У гуппи ярко окрашенные самцы более привлекательны для самок, но и легче выедаются хищниками. Эндлер, в 1970-х гг. первым оценивший возможности тринидадских речек для исследований по «экспериментальной эволюции», писал, что именно «равнодействующая» между предпочтением самок и выеданием хищников обеспечивает значительные различия в окраске самцов между разными местообитаниями.
То есть в первом случае рост селективного давления хищников пропорционально ослабляет давление полового отбора: чтобы сохранить прежнюю устойчивость, популяция увеличивает вложения в воспроизводство. Вместе с уже описанными эффектами означает свёртывание социальной коммуникации, а не совершенствование её, с деградацией пространственно-этологической структуры популяции, когда брачные взаимодействия идут «по экономному варианту». И действительно, очень многие популяции, оказавшись в экстремальных условиях плохой погоды, нехватки корма, повышенного риска хищничества, или на краю ареала, осуществляют коммуникацию «по экономному варианту», чем приспосабливаются к средовой экстремальности.
Куда интересней другой вариант, зафиксированный у малой южной колюшки по сравнению с близкородственной формой – девятииглой колюшкой. В местообитаниях первой пресс хищников много выше, тем не менее здесь брачная коммуникация под давлением того же отбора совершенствуется, а не свёртывается (и соответственно, социальная организация усложняется). В этом случае под воздействием хищников экспрессивность брачных демонстраций падает по сравнению со второй формой, также как падает интенсивность взаимной стимуляции партнёров в наиболее рискованное время нереста. Однако стереотипность демонстрирования возрастает в существенно большей степени, чем падает экспрессивность демонстраций, сексуально мотивированные реакции индивидов куда точнее «укладываются» в видоспецифические формы демонстраций, а это ведёт к большей эффективности брачной коммуникации, достигающейся при меньших затратах.
Иными словами, здесь отбор со стороны хищника не только не отменяет давления полового отбора, но даже усиливает его, ибо использование партнёрами во время нереста более эффективных сигналов вместо стимулов увеличивает селективность поведения тех и других. Соответственно, в этом случае совершенствуются оба типа поведения рыбок – и связанное со спасением от хищника, и связанное с брачными отношениями. Поэтому второй вариант – адаптация широкого значения, «микроскопический ароморфоз», тогда как первый – всего лишь узкая специализация. Увы, у гуппи в исследованиях наблюдается именно он. ].
Иными словами, в опытах было показано, что хищники не просто контролируют популяции жертв в экологическом масштабе времени, но и управляют их эволюцией (уже в эволюционном масштабе). И освобождение от пресса хищничества запускает эволюцию в противоположную сторону, причём изменения происходят очень быстро: для становления значимых различий по некоторым признакам достаточно 2.5 лет. Печальным побочным следствием этой эволюции становится исключительная уязвимость изменившихся экспериментальных популяций к риску хищника, если те вдруг будут реинтродуцированы в Б.
Для проверки этого предположения были проведены 2 обратных переселения особей из экспериментальных популяций, у которых поведения бегства от хищника уже сильно ослаблено, а брачное поведение, увеличивающее риск, напротив, возросло в экспрессивности. В обоих случаях исход был плачевным: переселенцы вымерли от хищничества, не успев образовать устойчивую популяцию. Напротив, все экспериментальные переселения из А в Б были успешными, ни одна такая колония не вымерла.
То же самое наблюдается и в природе, когда крупные хищники реколонизируют местообитания, в которых прежде были истреблены, или реинтродуцируются туда человеком. Известно много работ, посвящённых печальным результатам реинтродукции хищников в плане их «ударного» влияния на популяции жертв после отсутствия в течение периода от нескольких десятилетий до столетия. Carrott et al. (2005) описывает экспансию популяции реинтродуцированных волков в верховьях реки Мэдзисон на территории Йеллоустонского национального парка. За одну зиму они убили 20% местной популяции лосей. Как ожидается, численность популяции лося продолжит снижаться, до тех пор, пока в ответ на уменьшение числа лосей волки самки не уменьшат численности.
Berger et al. (2001) изучил реакцию европейских и американских лосей на реколонизацию волком и бурым медведем тех районов Скандинавии и Северной Америки, где соответствующие крупные хищники отсутствовали 50-130 лет. Популяции «наивных» жертв оказываются намного более уязвимы в первые моменты после вселения хищников, поскольку показывают резкое возрастание смертности молодых и взрослых особей (недопустимое в популяциях, устойчиво сосуществующих с соответствующим хищником).
Эти и другие данные показывают, что в отсутствие хищника нужно очень небольшое число поколений, чтобы приобрести исключительную уязвимость к нему — которой не было раньше и которая не очень совместима с выживанием популяции. Не показано, однако, действительно или нет эти изменения могут приписываться эволюции жертвы. Конечно, та степень, в которой изменения чувствительности жертвы к хищнику в отсутствие последнего суть действительно эволюционные изменения, вроде показанных у гуппи, определяет скорость, с которой жертвы могут выработать адаптивный ответ на реинтродуцированного хищника, и смогут ли вообще.
Хотя «наивная» жертва и особенно уязвима перед хищником, у неё всегда есть значительная фенотипическая пластичность (у птиц и млекопитающих — это пластичность поведения и психики в первую голову), за счёт которой жертва может очень быстро восстановить устойчивость к прессу хищничества. Например, хотя те же американские лоси очень уязвимы перед реколонизированными волками, поведенческие приспособления для защиты от хищников развиваются в одном поколении. Так, в местностях с полным набором хищников лоси соответствующим образом реагировали на звуковые и запаховые сигналы присутствия хищников – они стрессировались, включали оборонительную реакцию и т.п. А вот в местностях, где хищники долго отсутствовали, лоси реагировали на эти сигналы куда слабее или реагировали неадекватно – проявляли любопытство, приближение, исследовательские реакции.
Впрочем, в той же работе Berger et al. (2001) показано, что в популяциях, вновь столкнувшихся с хищниками, самки лосей, потерявшие из-за этого детёнышей, развивают сверхвысокую чувствительность к соответствующим сигналам, их потомки выучивают эти реакции. И, в принципе, популяция восстанавливает прежнюю устойчивость к хищникам за счёт эффектов подобного обучения (минимум 1 такой случай известен), так что в принципе реинтродукция хищников не обязательно ведёт к локальному вымиранию жертв – которых тоже надо охранять.
Это позволяет дополнить реаклимматизацию хищников действиями по снижению риска для жертв за счёт прайминга, вырабатывающего у жертв нужные оборонительные реакции на хищника, чтобы избежать ситуации «нос вытащишь – хвост увязнет». Тут нужно действовать примерно так, как у искусственно размножаемых редких видов перед выпуском в природу специально вырабатывают необходимые реакции на хищника, чтобы избежать непропорционально высокой гибели в первые дни после выпуска. Причём в природе не обязательно учить всех, можно только некоторых членов «дикой» популяции. Если речь идёт о птицах-млекопитающих, то достаточно их выработать у относительно небольшого % жертв, чтобы они потом распространялись с помощью обучения.
Сходные виды пластичности поведения, связанного с уклонением от нападения хищника, обнаружены и в других системах «хищник-жертва». Ydenberg et al. (2004) изучал реакцию перепончатопалых песочников на сапсанов, вновь многочисленных после 40-80 лет исключительной редкости. То есть частота встреч и нападений сокола на куликов сильно возросла; в ответ, кулики, мигрирующие севернее, в свои гнездовые местообитания, сокращают время на кормовые остановки и прибывают к гнездовьям с уменьшенным весом (видимо, вследствие уменьшения жировых запасов), но зато живыми.
Gil-de-Cosrta et al. (2003) анализирует реакцию обезьян-ревунов на гарпий-обезьяноедов, интродуцированных на о.Барро-Колорадо после 50-100 лет отсутствия. Обезьяны приобрели необходимое антихищническое поведение, запускаемое в т.ч. и криками гарпий.
Ещё очень важно подчеркнуть, что человеческая охота не может заменить крупных хищников, поскольку действует в прямо противоположную сторону. Во-первых, совершенствование оружия и способа охоты почти исключает для жертвы возможность убежать, «напрягши силы»,избежать преследования за счёт большей выносливости, то есть спасение возможно тут лишь случайным образом, а не является функцией от качества жертвы.
Далее, практически все жертвы, добытые хищником, оказываются либо больны, либо содержат существенные физические изъяны, снижающие жизнеспособность. Например, таковыми оказались всей сайгаки, пойманные борзыми при напуске. Напротив, когда стрелкам ставили задачу избирательно отстреливать именно самых больных и физически слабых сайгаков, 30% особей оказывалось сильными и здоровыми [Отсюда]. Я уж не говорю о ситуации, когда охота идёт не ради мяса, а ради трофеев, как в случае оленьих рогов или слоновьих бивней. В этих случаях добываются самые сильные и красивые животные, и на том же благородном олене показано значимое направленное уменьшение массы тела и размеров рогов за 30 лет непрерывной охоты, то есть охотники ведут «противоестественный отбор». Также, впрочем, как и рыболовы.
О том, что прямое приспособление за счёт поведенческой пластичности, имеющейся у всех особей (с последующим закреплением изменений эффектом Болдуина) куда эффективнее выработки приспособительных изменений отбором, поддерживающим только часть популяции и элиминирующим остальных, я уже писал на примере реакции больших синиц на глобальное потепление и связанный с ним сдвиг фенодат.
Иными словами, есть ли какая-нибудь возможность эффективного приспособления жертвы к новому для неё присутствию хищника в этом остром опыте? Есть, но достигается она не за счёт отбора (как видно из опыта с гуппи, при таком способе приспособления популяция не выдерживает увеличенного груза элиминации), а за счёт прямого приспособления, поведенческой пластичности и т.п. Конечно, это возможно лишь у групп с достаточно сложным поведением, чтобы соответствующая пластичность была, было её увеличение в ответ на средовой стресс и т.п. (пластичность не нужно путать с индивидуальным разнообразием, диапазон которого примерно одинаков от рыб до млекопитающих).
Напрашивающийся вывод из этой истории: эволюция скорей всего идёт не прямым, а парадоксальным способом. Во-первых, её стимулирует ослабление давлений отбора и смягчение конкурентного напряжения, а ужесточение того и другого заставит популяцию скорей вымереть, чем эволюционировать. Об этом писал ещё И.И.Шмальгаузен:
«И в наших культурах, и в естественных условиях, острая конкуренция ведёт к более или менее значительному истощению и снижению плодовитости всех особей, а не только к элиминации более слабых. В наших культурах, например, чрезмерно густые посевы и посадки связаны, поэтому, со снижением урожайности. Более истощёнными оказываются часто в этих условиях именно те особи, которые по своей наследственной природе являются наиболее плодовитыми. Это ведёт к отбору на меньшую плодовитость и, следовательно, к вырождению сорта.
В естественных условиях перенаселение и интенсивная конкуренция также ведут иногда к уменьшению плодовитости, но, главное, они всегда ведут ко всё более узкой специализации, связанной с более экономным использованием жизненных средств. Такая специализация закрывает, однако, перед организмом возможность развития в направлении широкой прогрессивной эволюции.
Поэтому и в естественных условиях более мягкие формы конкуренции и формы пассивного соревнования особей имеют известные преимущества. Они не только благоприятствуют жизни вида, но и определяют более широкие пути его прогрессивной эволюции».
Во-вторых, отбор не «движет» непосредственно теми изменениями, которые составляют элементарные эволюционные явления, «их пути пролагаются» или модификационной изменчивостью, связанной с той самой поведенческой (ростовой, физиологической) пластичностью, или дифференцирующей сортировкой особей внутри популяции. Отбор выступает лишь закрепителем изменений, он стабилизирует онтогенезы, увеличивая устойчивость направления их к новой норме.
Эволюционные и экологические процессы могут происходить одинаково быстро и влиять друг на друга
Алексей Гиляров
«Ничто в экологии не имеет смысла вне эволюции, а в эволюции — вне экологии». С этим высказыванием, представляющим собой парафраз знаменитой фразы Ф. Г. Добжанского «Ничто в биологии не имеет смысла, если не рассмотрено в свете эволюции», полностью согласен американский эколог Томас Шёнер (Thomas Schoener). В обзорной статье, опубликованной недавно в журнале Science, он подвел важнейшие итоги изучения взаимодействия экологических и эволюционных процессов на сравнительно коротких отрезках времени. В противовес традиционной точке зрения, согласно которой эволюционные преобразования происходят медленно, а экологические — быстро, исследования последних лет показали, что и те и другие могут происходить очень быстро, в одном временном масштабе. А действуя одновременно, они оказываются взаимосвязанными. Буквально за несколько поколений отбор подстраивает особенности организмов под изменения экологической обстановки, а сформированные эволюцией особенности организмов в свою очередь определяют их экологические характеристики, например рождаемость и выживаемость в тех или иных условиях. Однако на длительных промежутках времени отбор может неоднократно менять свое направление на противоположное (вслед за изменениями среды), вследствие чего усредненная картина может выглядеть довольно статичной.
То, что экологические обстоятельства нередко задают направление и скорость эволюционных преобразований, сомнений ни у кого не вызывает. Приобретение близкими видами черт, позволяющих им разойтись по разным нишам (и таким образом ослабить конкуренцию), совершенствование средств защиты жертв от хищника и средств нападения хищника на жертв, сопряженная эволюция (коэволюция) опыляемых растений и животных-опылителей. Подобных примеров эволюции, вызванной экологическими факторами, можно привести много. Традиционно считалось, что экологические и эволюционные процессы происходят в совершенно разных масштабах времени. Экологические процессы — быстрые, действующие на промежутках времени, измеряемых несколькими поколениями. Эволюционные — медленные, требующие сотен и даже тысяч поколений. Отсюда и обычно принимаемое допущение, согласно которому рассмотрение экологических событий (например, изменения численности какой-либо популяции) вовсе не требует учета эволюционных процессов, протекающих слишком медленно, чтобы оказывать на них сколь-либо значимое влияние.
Однако в последнее время эти, казалось бы, устоявшиеся положения начинают пересматриваться. Так, исследователи из Корнелловского университета (Yoshida, Ellner, Jones, et al., 2007) вдруг обнаружили, что в лабораторной системе «хищник–жертва» (где «хищник» — это микроскопическое многоклеточное животное коловратка Brachionus, а «жертва» — одноклеточная водоросль хлорелла), возникают такие колебания численности, которые можно было бы ожидать, только если допустить быструю эволюцию жертвы (или хищника) в ходе самого эксперимента. И, как выяснилось, такая эволюция действительно происходила: по мере того как хлорелла поедалась коловратками, ее пригодность в качестве пищи быстро снижалась — коловратки на такой измененной хлорелле росли значительно хуже и, соответственно, ослабляли свой пресс на водоросли (см.: А. Гиляров. Смена правил в ходе игры // Природа, 2003. № 12, с. 75–76).
В некоторых случаях мы видим очень быстрое изменение морфологических, физиологических или поведенческих особенностей организмов в ответ на изменение экологических условий. К примеру, у галапагосских земляных вьюрков Geospiza fortis (см.: Darwin’s finches), которых в течение ряда лет тщательно изучали Розмари Грант и Питер Грант (B. Rosemary Grant and Peter R. Grant), размер клюва менялся вслед за изменениями размерного состава семян — их основной пищи. После нескольких сухих лет подряд, когда семян было немного, но они были крупными, естественный отбор был направлен на увеличение размера клюва, а после нескольких влажных лет, когда семян стало много, но они были мелкими, отбор сменил направление и стал работать на уменьшение размера клюва.
Еще один хорошо известный пример (Reznick, et al. 1997) — это уменьшение размеров тела и сокращение возраста достижения половозрелости у самцов рыб гуппи в ответ на усиление пресса хищных рыб, предпочитавших более крупную добычу. Данный результат был получен в ходе полевых экспериментов непосредственно в местах обитания природных популяций гуппи в Центральной Америке, причем значимые изменения произошли уже за 12–18 поколений.
Но если эволюционные (то есть закрепляемые генетически) изменения в популяциях каких-либо организмов происходят столь же быстро как и процессы экологические, то между ними устанавливается обратная связь. Получается, что не только экологические факторы воздействуют на эволюцию организмов, но и эволюционные преобразования влияют на экологические взаимодействия. Эту мысль развивает и иллюстрирует разными примерами в своей обзорной статье Томас Шёнер из Калифорнийского университета в Дэвисе (University of California, Davis).

Схема экспериментального исследования, выявляющего эко-эволюционную динамику у ящериц Карибских островов. (A) До вселения на остров крупной хищной ящерицы Leiocephalus carinatus мелкая ящерица анолис Anolis sagrei держалась как на поверхности земли, так и на нижних ветвях деревьях. (B) Сразу после вселения L. carinatus численность анолисов существенно сократилась, и они стали держаться на более высоко расположенных тонких ветках, куда не мог добраться хищник. (C) Спустя несколько лет мы видим результат быстрой эволюции A. sagrei, которая могла быть ускорена прессом хищника. У анолисов стали короче ноги, и они смогли осваивать большее пространство кроны. Численность их при этом возросла. По данным: S. Y. Strauss, J. A. Lau, T. W. Schoener, P. Tiffin. Evolution in ecological field experiments: Implications for effect size // Ecol. Lett. V. 11. P. 199 (2008). Из обсуждаемой статьи T. Schoener в Science
Так, в уже упомянутом примере с земляными вьюрками быстро протекающая эволюция формирует свойства особей, которые определяют характер ответа на изменившиеся экологические условия. После нескольких сухих лет клюв вьюрков становится больше, они начинают более эффективно использовать крупные семена и, соответственно, быстрее размножаться. Но при наступлении более влажного периода и уменьшении размера семян преимущества, даваемые более крупным клювом, теряются, то есть не используются полностью возможности откорма птиц. Отбор меняет направление на уменьшение размера клюва, что будет способствовать увеличению скорости популяционного роста. Таким образом, наблюдаемое изменение численности есть результат действия с одной стороны чисто экологических факторов, например нехватки корма в сложившихся неблагоприятных погодных условиях, а с другой — особенностей самих организмов (например, их плодовитости), только что скорректированных естественным отбором.
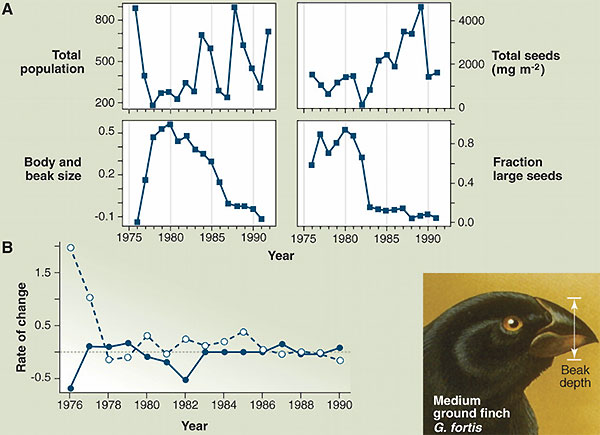
Быстрая, меняющая направление, эволюция галапагосского земляного вьюрка Geospiza fortis.
A. Слева вверху — численность популяции вьюрков. Слева внизу — относительные изменения размера тела и размера клюва (эти признаки тесно сопряжены и рассматриваются как единый показатель). Справа вверху — общее количество семян (мг/м2). Справа внизу — доля крупных семян. Если в конце 1970-х — начале 1980-х семян было немного, но преобладали крупные семена, то в конце 1980-х — начале 1990-х семян стало больше, но они были мелкие. Соответственно менялся и размер клюва вьюрков.
B. Экологическая (сплошная линия) и эволюционная (пунктирная линия) составляющие скорости наблюдаемых изменений численности популяции земляного вьюрка за весь период наблюдений. В середине 1970-х значительный вклад был со стороны эволюционных преобразований, а затем вклад их стал почти равным.
Изображение из обсуждаемой статьи T. Schoener (Science. 28 January 2011. V. 331. P. 426–429) по Hairston, et al. 2005. (Исходные данные P. Grant & R. Grant)
Возникает вопрос: а можно ли в этом переплетении внешних и внутренних факторов оценить вклад в наблюдаемое изменение численности популяции процессов экологических и эволюционных? Эту непростую задачу решили Нельсон Хэйрстон (Nelson G. Hairston Jr.) и его коллеги, опубликовавшие в 2005 году статью, в которой применили статистический прием (вариант дисперсионного анализа), позволяющий выделить, грубо говоря, экологический и эволюционный компоненты популяционной динамики.
Результаты этого анализа в применении к данным по галапагосским вьюркам показали, что вклад «эволюционной составляющей» мог иногда в 2,2 раза превышать «экологическую составляющую». В то же время, применив тот же прием к собственным данным по изменению жизненного цикла веслоногого рачка Onychodiaptomus sanguineus (который мог образовывать или покоящиеся, или немедленно развивающиеся яйца в зависимости от наличия хищника), Хэйрстон и его коллеги показали, что эволюционный вклад в четыре раза меньше экологического, хотя он и остается значимым.
Еще одна группа авторов использовала методику Хэйрстона и его коллег для анализа данных по динамике численности нескольких видов копытных. Результат этого анализа показал примерно равный вклад эволюционной и экологической составляющей в изменение численности популяции.
Невольно возникает вопрос: почему эффект эволюционных преобразований на экологические процессы был выявлен только недавно? По-видимому, одна из причин — это недооценка того, что эволюция может в течение короткого времени протекать очень быстро, но затем остановиться (состояние стазиса) или же изменить направление на противоположное. Чем более продолжительный интервал времени мы рассматриваем, тем сильнее сказывается эффект усреднения, маскирующий процессы, реально происходившие на коротких отрезках времени. Это на самом деле отмечалось уже не раз, в частности в исследовании Хендри и Киниссона (Hendry, Kinisson. The pace of modern life: measuring rates of contemporary microevolution (PDF, 1,7 Мб) // Evolution, 1999. V. 53. P. 1637–1653).
На график из этой статьи, показывающей, как сокращается скорость эволюции по мере увеличения времени рассмотрения данных (время оценивается в числе поколений), Хэйрстон и его соавторы нанесли данные по галапагосскому земляному вьюрку и веслоногому рачку Onychodiaptomus sanguineus — причем не только имеющиеся средние оценки, но и данные по максимальной и минимальной скорости эволюции. отмеченной для этих двух видов. Выяснилось, что средние оценки прекрасно ложатся на общую зависимость, а вот максимальные и минимальные значения дают представление о реальном разбросе скорости эволюции, оцененной на коротких интервалах.
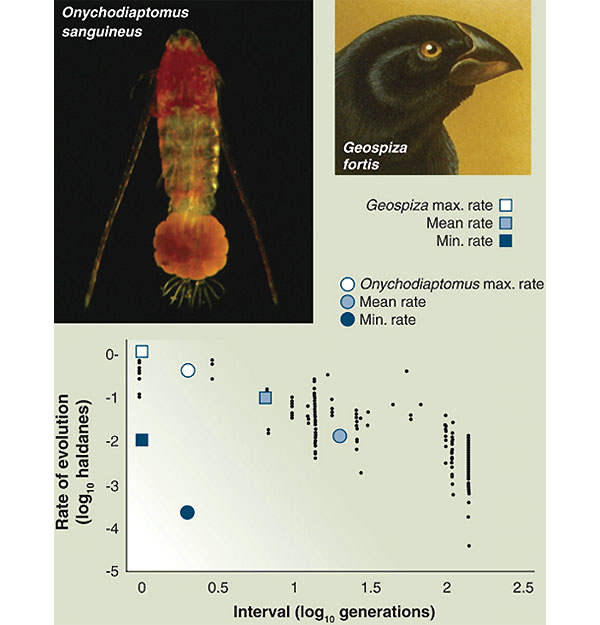
Скорость эволюции (в специальных единицах «холдейнах» — в честь британского ученого Холдейна) в зависимости от числа поколений в популяциях разных организмов. График взят из работы Hendry and Kinnison (1999. Evolution. V. 53. P. 1637), обобщивших большое количество данных по разным видам (мелкие черные точки на корреляционном поле), а на него нанесены данные, рассчитанные для вьюрка G. fortis (квадратики) и для веслоногого рачка O. sanguineus (кружочки). Для этих двух видов показаны: самая низкая, самая высокая и средняя скорость эволюции в расчёте на поколение для 30-летнего периода (вьюрки) и 10-летнего (веслоногий рачок). Видно, что средние значения хорошо ложатся на выведенную ранее зависимость (чем короче рассматривается интервал, тем быстрее происходит эволюция), но минимальные и максимальные значения показывают огромный реальный разброс данных. Из обсуждаемой статьи T. Schoener в Science (исходный график из работы Hairston et al. 2005)
Подводя итоги своего обзора, Шёнер напоминает, что формирование в 1930–40-х годах нового подхода к изучению эволюции, так называемого «Нового Синтеза» (см. также: Синтетическая теория эволюции), объединило усилия морфологов, палеонтологов, систематиков и генетиков, но обошлось без участия экологов (хотя на самом деле работы по экспериментальной экологии Георгия Францевича Гаузе определенную роль всё же сыграли. — Примечание А. Г.). Но тогда экология не была еще столь развитой наукой как сейчас. В нынешней же ситуации экология уже стала частью нового подхода, который можно назвать «Новейшим Синтезом». Фактически мы должны говорить об «эколого-эволюционной динамике», изучение которой может принести неожиданные открытия.
Источник: Thomas W. Schoener. The newest synthesis: understanding the interplay of evolutionary and ecological dynamics // Science. 2011. V. 331. P. 426–429.
См. также:
1) Nelson G. Hairston Jr, Stephen P. Ellner, Monica A. Geber, Takehito Yoshida, Jennifer A. Fox. Rapid evolution and the convergence of ecological and evolutionary time // Ecology Letters. 2005. V. 8. P. 1114–1127. Вся статья в свободном доступе (PDF, 241 Кб).
2) Peter R. Grant, B. Rosemary Grant. Unpredictable evolution in a 30-year study of Darwin’s finches // Science. 2002. V. 296. P. 707–711.
3) Экспериментально подтверждено влияние видообразования на свойства экосистем, «Элементы», 6.04.2009.
4) Takehito Yoshida, Stephen P. Ellner, Laura E. Jones, Brendan J. M. Bohannan, Richard E. Lenski, Nelson G. Hairston Jr. Cryptic population dynamics: rapid evolution masks trophic interactions // PLoS Biol. 2007. V. 5 (9): e235. doi:10.1371/journal.pbio.0050235 (вся статья в свободном доступе).
5) David N. Reznick, Frank H. Shaw, F. Helen Rodd and Ruth G. Shaw Evaluation of the rate of evolution in natural populations of guppies (Poecilia reticulata) // Science. 1997. V. 275. P. 1934–1937.
6) A. P. Hendry, M. T. Kinnison. The pace of modern life: Measuring rates of contemporary microevolution (PDF, 1,7 Мб) // Evolution. 1999. V. 53. P. 1637–1653.
Источник elementy.ru
Исчезновение птиц с большим клювом привело к эволюции размера семян пальм
Алексей Гиляров

Тукан Ramphastos dicolorus, способный потреблять крупные плоды пальмы E. edulis, сохранился только в немногих ненарушенных местообитаниях. Фото Ricardo Venerando с сайта www.flickr.com/photos/venerando/6006399811
На примере разных популяций одного вида бразильских пальм удалось показать, что в эволюции размера семян решающая роль принадлежала птицам — в первую очередь тем, которые были способны потреблять крупные плоды (например, туканам). На территориях, подвергнувшихся антропогенному воздействию, эти птицы давно истреблены или крайне малочисленны. Поскольку нет потребителей (а они же и разносчики) крупных семян, исчезают и образующие их пальмы. Их место занимают пальмы того же вида, но продуцирующие мелкие семена, которые разносятся другими птицами. В тех местах, где еще сохранились девственные леса и есть птицы, способные потреблять крупные семена, пальмы продолжают образовывать семена большого размера
Наблюдаемое повсеместно сокращение биоразнообразия — это не только вымирание видов, но порой и уменьшение внутривидового разнообразия, например исчезновение из популяции наиболее крупных форм. Чаще всего такое происходит в результате прямого истребления их человеком. Но иногда возникает так называемый каскадный эффект — чреда воздействий «сверху вниз» через промежуточные трофические уровни. Так, человек в ходе промысла (охоты, рыбной ловли) может изымать хищников высшего уровня, находящихся на самом верху трофической пирамиды, а ослабление пресса этих хищников приводит к определенным сдвигам в популяциях их жертв — например, к изменениям размерной структуры. Фактически исследователи могут наблюдать при этом начало эволюционных преобразований, протекающих непосредственно у них на глазах.

A — плоды пальмы Euterpe edulis. B — туканет Selenidera maculirostris с семенем пальмы в клюве. Поедая мякоть плода, птицы отрыгивают семена (в некоторых случаях они проходят через кишечник). C — на земле видны отрыгнутые семена и плоды, которые не удалось унести (заметны следы от клюва птиц с небольшой глоткой). D — семена в экскрементах птиц (Penelope superciliaris). E — упавшие плоды и семена подвергаются воздействию патогенных грибов, а также поедаются животными. Фотографии разных авторов, смонтированные воедино, из дополнительных материалов к обсуждаемой статье в Science
Статья, появившаяся недавно в журнале Science, посвящена анализу необычной ситуации — изменению размеров семян одного вида пальм, Euterpe edulis, при исчезновении определенных видов птиц, ранее поедавших их плоды и таким образом осуществляющих их успешное расселение. Авторам работы (а это большая группа бразильских исследователей, а также их коллеги из Мексики и Испании) удалось собрать обширные данные по размеру семян пальмы Euterpe edulis в 22 популяциях этого вида из разных мест восточной части Бразилии (см. карту). Известно, что крупные семена E. edulis могут потребляться только птицами с большим размером клюва и глотки (диаметр глотки >12 мм), например такими, как туканы (Ramphastos) или туканеты (Pteroglossus, Selenidera), тогда как мелкие семена поедаются многими видами птиц, в том числе и с небольшой глоткой (диаметр <12 мм). Хотя на первый взгляд может показаться, что крупный размер семян — признак для растений полезный, так как проростки их на ранних стадиях получают больше питательных веществ, у них есть и существенный недостаток: распространять их могут только птицы с большой глоткой.

Распределение частот семян разного размера (диаграммы вокруг карты), образуемых в 22 популяциях пальмы Euterpe edulis. Красными кружками (1–7) показаны популяции из нарушенных местообитаний, где питающиеся крупными плодами птицы были истреблены полностью или стали крайне малочисленными. Черными точками показаны популяции из ненарушенных местообитаний, где такие птицы еще остались. Красным и черным цветом выделены также соответствующие им диаграммы. Красная вертикальная черта на каждой диаграмме отмечает 12 мм — критический размер, соответствующий минимальному диаметру глотки птиц, способных потреблять крупные плоды. Зеленым цветом на карте показаны остатки леса. Из обсуждаемой статьи в Science
В отсутствие таких птиц (а они нередко истребляются человеком), расселение пальм, образующих крупные семена, становится невозможным. Семена же, упавшие около материнского дерева, дают проростки, которые в дальнейшем обычно не выживают из-за напряженной внутривидовой конкуренции, нехватки света и грибковых заболеваний. Такая же участь постигает и проростки из мелких семян, если они остаются около материнского растения. Однако разносить мелкие семена могут многие птицы, в том числе и с небольшим клювом и неширокой глоткой. Птица, схватившая плод, обычно объедает мясистую часть, а само семя отрыгивает или выделяет с экскрементами. Всхожесть таких семян даже более высокая, чем семян, не тронутых птицами.
Статистический анализ всей совокупности данных выявил четкую тенденцию — уменьшение размера семян в районах с нарушенными человеком местообитаниями, там, где полностью истреблены или доведены до крайне низкой численности птицы, способные потреблять крупные плоды. К таким птицам, с диаметром глотки более 12 мм, относятся туканы, туканеты и еще ряд видов из других семейств. Именно они обеспечивают расселение крупных семян. Птицы с небольшой глоткой (диаметр менее 12 мм), например белошейный дрозд Turdus albicollis, встречаются как в нарушенных, так и в ненарушенных местообитаниях, причем в первом случае они обеспечивают расселение 98% семян, а во втором (там, где есть потребители крупных семян) только 33%. Измельчание семян произошло в нарушенных местообитаниях, там, где не было потребителей крупных плодов.
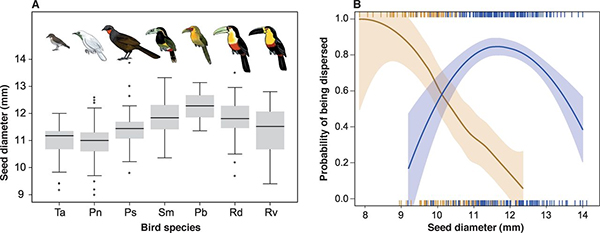
A — диапазон размеров семян пальмы E. edulis, потребляемых разными видами птиц. Горизонтальной чертой в каждом случае показано среднее значение, границы серого прямоугольника («ящика») определяются как среднее ±1 стандартная ошибка (standard error, SE), а 95-процентные доверительные интервалы задаются вертикальными линиями («усами»). Черные точки («выбросы», outliers) — единичные находки, не попадающие в границы доверительного интервала. Данные приведены для птиц, являющихся основными потребителями плодов E. edulis. Расшифровка названий птиц (слева направо): Ta — Turdus albicollis, Pn — Procnias nudicollis, Ps — Penelope superciliaris, Sm — Selenidera maculirostris, Pb — Pteroglossus bailloni, Rd — Ramphastos dicolorus, Rv — Ramphastos vitellinus.
B — вероятность распространения птицами семян разного размера (по горизонтальной оси — диаметр семени в мм). Коричневая кривая — нарушенные местообитания (нет потребителей крупных семян). Синяя кривая — ненарушенные местообитания (есть птицы, поедающие крупные плоды).
Из обсуждаемой статьи в Science
Согласно расчетам авторов, время, необходимое для произошедшей эволюции размера семян, оценивается примерно в 100 лет. Но плантации кофе, ради которых вырубались леса, начали разбивать в 1800-х годах. Таким образом, прошедшего времени хватило для того, чтобы сформировались наблюдаемые различия между размерами семян в нарушенных и ненарушенных местообитаниях.
Источник: Mauro Galetti, Roger Guevara, Marina C. Côrtes, Rodrigo Fadini, et al. Functional Extinction of Birds Drives Rapid Evolutionary Changes in Seed Size // Science. 2013. V. 340. P. 1086–1090.
Источник elementy.ru