К. А. Роговин
Резюме. В биомедицинской науке последствия стресса в раннем онтогенезе в большинстве случаев рассматриваются как негативные для организма, вызывающие нарушения развития репродуктивных функций, иммунной, нейроэндокринной систем, мозга и поведения, включая когнитивные способности и устойчивые расстройства психики. На этом фоне набирают силу исследования, обсуждающие последствия ранних стрессов с позиции их возможной адаптивности, оцениваемой как увеличение приспособленности (fitness) в текущем и последующих поколениях. В обзоре дано краткое описание основных механизмов обусловленного материнским стрессом онтогенетического программирования организма потомка на основе обобщающих работ по млекопитающим. Основное же внимание уделено экспериментам в природе, либо экспериментам, моделирующим природную ситуацию, в которых на некоторых видах позвоночных животных были исследованы последствия материнских стрессов для потомков на фоне контролируемых изменений среды обитания, включая и среду социальную. Фенотипически проявляющиеся у потомков последствия ранних стрессов оказываются полезными для них (адаптивными) в тех случаях, когда условия среды (в т. ч. социальной), в которой существовал организм матери в период формирования яйца или беременности и сразу после рождения выводка, соответствуют условиям среды их будущей жизни. Для матери стрессовые состояния, транслируемые потомкам, могут быть выгодны, поскольку оптимизируют
затраты на текущее размножение и в конечном счете могут повышать ее совокупную приспособленность независимо от того, повышают они или понижают приспособленность потомков в ближайшей перспективе. Эволюционно-экологический подход в изучении последствий ранних стрессов может быть полезным для понимания процессов формирования здоровья человека. Накопленные на сегодня данные вселяют надежду на то, что будет наконец достигнуто понимание необходимости сокращения несоответствия между пренатальной и будущей средой жизни человека, несоответствия, существенно повышающего риски заболеваний в зрелом возрасте [главное, чтобы эту — биологически неоспоримую — идею реализовывали в рамках левой идеологии, что никто не должен быть обделён в детстве из-за бедности, пьянства, «цветного» происхождения и т.д. уязвимости родителей, общество должно вкладываться в создание равных возможностей реализации детей низкостатусных и/или уязвимых групп, тем более это выгодно для экономики в целом. Но та же идея социальна опасна, если реализуется правыми как «биологический» аргумент в пользу кастового общества, против социальной мобильности и за естественность неравенства. Прим.публикатора].
В биомедицинской науке последствия стресса в раннем онтогенезе в большинстве случаев рассматриваются как негативные для организма, вызывающие нарушения развития репродуктивных функций, иммунной, нейроэндокринной систем, мозга и поведения, включая когнитивные способности и устойчивые расстройства психики. На этом фоне набирают силу исследования, обсуждающие последствия ранних стрессов с позиции их возможной адаптивности, оцениваемой как увеличение приспособленности (fitness) в текущем и последующих поколениях.
В обзоре дано краткое описание основных механизмов обусловленного материнским стрессом онтогенетического программирования организма потомка на основе обобщающих работ по млекопитающим. Основное же внимание уделено экспериментам в природе, либо экспериментам, моделирующим природную ситуацию, в которых на некоторых видах позвоночных животных были исследованы последствия материнских стрессов для потомков на фоне контролируемых изменений среды обитания, включая и среду социальную. Фенотипически проявляющиеся у потомков последствия ранних стрессов оказываются полезными для них (адаптивными) в тех случаях, когда условия среды (в т. ч. социальной), в которой существовал организм матери в период формирования яйца или беременности и сразу после рождения выводка, соответствуют условиям среды их будущей жизни.
Для матери стрессовые состояния, транслируемые потомкам, могут быть выгодны, поскольку оптимизируют затраты на текущее размножение и в конечном счете могут повышать ее совокупную приспособленность независимо от того, повышают они или понижают приспособленность потомков в ближайшей перспективе. Эволюционно-экологический подход в изучении последствий ранних стрессов может быть полезным для понимания процессов формирования здоровья человека. Накопленные на сегодня данные вселяют надежду на то, что будет наконец достигнуто понимание необходимости сокращения несоответствия между пренатальной и будущей средой жизни человека, несоответствия, существенно повышающего риски заболеваний в зрелом возрасте.
В океане исследований стресса периода раннего онтогенеза и его последствий существует, однако, относительно молодое и обособленное течение – исследования, обсуждающие последствия ранних стрессов с позиции их эволюционной значимости. Стрессовые состояния материнского организма до рождения детеныша или откладки яйца и стрессоры, воздействующие на новорожденный организм в период, непосредственно следующий за появлением на свет, влияют на его развитие, отражаются на строении формирующихся органов и систем, механизмах функциональных связей и поведении (Maccari et al., 2003; Weinstock, 2005; Lupien et al., 2009; McEwen, 2012; Sheriff, Love, 2013).
В ходе формирования в онтогенезе физиологических функций и механизмов поведения происходит их настройка – “программирование” – в соответствии с текущими и ожидаемыми условиями жизни организма.Научная литература, посвященная последствиям для потомства стресса, который испытывала мать (matternaly derived stress), как и вообще стрессу в раннем онтогенезе, поистине огромна. Публикации на эту тему исчисляются тысячами.
В биомедицинской науке последствия стресса в раннем онтогенезе в большинстве случаев рассматриваются как негативные для организма, вызывающие нарушения развития репродуктивных функций (Dobson, Smith, 2000), иммунной (Merlot et al., 2008) и нейроэндокринной систем (Glover et al., 2010), мозга и поведения, включая когнитивные способности и устойчивые расстройства психики (шизофрения, депрессия, синдром повышенной тревожности, аутизм и др.; Weinstock, 2008; Charil et al., 2010; Glover, 2011; Shishkina, Dygalo, 2017). Этим обусловлен непрекращающийся интерес к проблематике.
Эффекты этих изменений могут проявляться в течение жизни не только как различные отклонения от нормы, снижающие приспособленность, но и как вполне адаптивные явления, значение которых становится понятным при рассмотрении их на фоне меняющихся условий жизни в контексте конфликтов жизненного цикла (life history tradeoffs) и событий популяционного уровня (Sheriff et al., 2011; Sheriff, Love, 2013). Сам же механизм онтогенетического программирования может иметь адаптивную эволюционно-генетическую основу и обеспечивать передачу эффекта неблагоприятного воздействия, перенесенного предками, в ряду поколений (Дыгало, 2007)
Влияние повышенной адренокортикальной активности (стрессированности) на приспособленность (fitness) к настоящему времени хорошо документировано (Dufty et al., 2002; Cavigelli, McClintock, 2003; Boonstra, 2005; Wingfield, 2005; Hadany et al., 2006; Blas et al., 2007; Роговин, Мошкин, 2007; Новиков, Мошкин, 2009). Адаптивное значение внутри- и межпопуляционной изменчивости в уровне стрессированности неоднократно подтверждалось исследованиями в природе.
Это и снижение чувствительности к стрессорам у размножающихся в горах и в Арктике птиц (Wingfield, Hunt, 2002; Breuner, Hahn, 2003), и снижение реактивности гипоталамо-гипофизарно-надпочечниковой системы к стрессорам в течение репродуктивного цикла, уменьшающее вероятность его прерывания (Holberton, Wingfield, 2003; Love et al., 2004), и коррелирующие с уровнем глюкокортикоидной активности выживаемость и вероятность рекрутирования молодых животных в локальную популяцию, социум (Cavigelli, McClintock, 2003; Blas et al., 2007; Meylan et al., 2012).
В основе этих адаптаций мог лежать механизм онтогенегического программирования. Число исследований эволюционной направленности последствий стресса в раннем онтогенезе невелико и по сравнению с классическим периодом эволюционной экологии, с присущим этому периоду пристальным вниманием к стрессу как регулятору популяционных процессов (Christian, 1950, 1963, 1968, 1971, 1980; Шилов, 1984; Мошкин и др., 1990; Wingfield, Ramenofsky, 1999; Wingfield, Romero, 2001; Роговин, Мошкин, 2007; Новиков, Мошкин, 2009). Между тем именно популяционный аспект проблемы стресса в раннем онтогенезе представляется чрезвычайно интересным не только в плане теоретическом, но и в плане возможности прогнозирования демографических последствий стрессов, испытываемых в раннем онтогенезе человеком (Glover, 2011).
Вопрос о существовании адаптивной компоненты явления не имеет смысла вне связи с условиями его реализации. Однако среди многочисленных исследований влияния материнского стресса на развитие структур и функций мозга, кортикостероидной оси стресса и поведения потомков, лишь в немногих из них эффекты материнского стресса оцениваются с учетом условий пренатального периода и постнатальной жизни (Blas et al., 2007; Cyr, Romero, 2007; Lowe, Williams, 2008a, b; Sheriff et al., 2011; Sheriff, Love 2013).
Предлагаемый вниманию читателей обзор посвящен обсуждению адаптивного значения последствий стресса в раннем онтогенезе. В обзоре будет дано краткое и, в силу этого, неизбежно поверхностное описание механизма, обусловленного материнским стрессом и основанного на геномных взаимодействиях онтогенетического программирования организма потомка на основе обобщающих работ по млекопитающим. Эта тема огромна и выходит за рамки нашей задачи. Основное внимание будет уделено экспериментам в природе, либо экспериментам, моделирующим природную ситуацию, в которых на некоторых видах позвоночных животных были исследованы последствия материнских стрессов для потомков на фоне контролируемых изменений среды обитания, включая и среду социальную (социальное окружение).
Теория стресса была сформулирована Селье (Selye, 1950, 1952, 1981) применительно к организму млекопитающего. Механизм неспецифического адаптационного синдрома (Selye, 1950, 1952, 1981) был подробно изучен и исследуется ныне главным образом у немногих модельных видов млекопитающих (крысы, мыши, морские свинки, некоторые обезьяны), а также у человека (Wingfield, Sapolsky, 2003; Weinstock, 2008; McEwen, 2012; McEwen et al., 2012). Однако механизм нейроэндокринных взаимодействий кортикоидной оси стресса консервативен. В основных чертах он присущ всем позвоночным животным (птицы: Banerjee et al., 2012; Zimmer, Spencer, 2014; рептилии: Moore, Jessop, 2003; Silvestre, 2014; амфибии: Moore, Jessop, 2003; Hu et al., 2008; современные костистые рыбы: Feist, Schreck, 2001; Auperin, Geslin, 2008; Steenbergen et al., 2011).
У амниот действует гипоталамо-гипофизарно-надпочечниковая система, конечным продуктом которой и основным регулятором являются выделяемые корой надпочечников глюкокортикоиды – кортизол или кортикостерон (Sapolsky et al., 2000; Wingfield, Sapolsky, 2003; Wingfield, 2005). У костистых рыб и амфибий действует гипоталамо-гипофизарно-интерренальная система, в которой глюкокортикоидный гормон вырабатывается интерренальными железами (Wendelaar Bonga, 1997; Bernier, Peter, 2001; Dores, Garcia, 2015).
Принятые в статье сокращения
Содержание
- 1 Принятые в статье сокращения
- 2 Границы понятия “стресс в раннем онтогенезе”
- 3 Стрессоры в моделях изучения эффектов стресса в раннем онтогенезе
- 4 Стресс и эпигенетическое программирование организма в раннем онтогенезе
- 5 Постнатальное программирование
- 6 Популяционные последствия стресса в раннем онтогенезе
- 6.1 1. Классический период популяционной экологии
- 6.2 2. Оптимизация распределения репродуктивного вклада в потомство и пренатальный стресс
- 6.3 3. Эпигенетическое программирование морфофункциональных и поведенческих качеств потомства у рыб
- 6.3.1 3.1. Рыбы коралловых рифов, социальная конкуренция и трэйдоффы между выживаемостью и смертностью
- 6.3.2 3.2. Трехиглая колюшка и хищники – формирование адаптивного профиля поведения мальков путем модификации развития икры под влиянием материнского стресса
- 6.3.3 3.3. Родительская забота у рыб и социальное поведение потомков: программирование нейроэндокринной оси стресса у цихлид Neolamprologus pulcher
- 6.4 4. Плотность населения ящериц и филопатрия
- 6.5 5. Европейский скворец и гипотеза “комплементарности материнского качества и требований потомства” (Matternal Match Hypothesis)
- 6.6 6. Влияние нестабильной социальной среды во время беременности на развитие потомков у морских свинок
- 6.7 7. Американский заяц-беляк (Lepus americanus) и 10-летний цикл в системе “хищник–жертва”
- 6.8 8. Последствия пренатального стресса у людей: патологии или адаптации
- 7 Адаптивный потенциал стресса периода раннего онтогенеза
- 8 Заключение
ГГНС (HPA – hypothalamic-pituitary-adrenal axis) – гипоталамо-гипофизарно надпочечниковая система (ось). Мы используем традиционную аббревиатуру ГГНС, хотя в действительности помимо собственно гипоталамуса, гипофиза и надпочечников в центральную нейроэндокринную ось стресса у млекопитающих входит почти вся лимбическая система мозга и фронтальная кора, где имеются рецепторы кортикоидных гормонов (McEwen, 2012);
ГК – глюкокортикоиды;
МК – минералокортикоиды;
ГР – рецепторы глюкокортикоидов, продукты
активности генов (gr);
МР – рецепторы минералокортикоидов, продукты активности генов (mr);
КРГ (CRH – corticotropin-releasing hormone) – кортикотропин-рилизинг гормон, кортиколиберин;
СТМ (МDS – maternally derived stress) – стресс, транслированный организмом матери организму потомка.
Границы понятия “стресс в раннем онтогенезе”
Под стрессом в раннем онтогенезе мы понимаем нейроэндокринные эффекты, которые организм матери с повышенной активностью центральной нейроэндокринной оси стресса оказывает на созревающий ооцит или плод, и меняющие его развитие с длительными относительно устойчивыми последствиями, проявляющимися в течение жизни потомка. Сюда же относятся эффекты, обусловленные родительским поведением матери, социальным окружением, хищником или действием других внешних стрессоров в ранний постнатальный период жизни, влияющие на ход нормального развития организма потомка.
Стресс в раннем онтогенезе близок к часто используемому понятию стресса, транслируемого организмом матери потомкам (maternally derived stress). В исследованиях СТМ у млекопитающих внимание акцентируется на повышенной активности ГГНС матери и гуморальных эндокринных влияниях материнского организма на развивающийся плод (пренатальный стресс у млекопитающих). В понятие СТМ также входят поведенческие эффекты матери (качество материнской заботы) в неонатальный период (ранний постнатальный период). У яйцекладущих животных влияние стресса матери на потомство распространяется на весь период от развития фолликула до откладки яйца и период родительской заботы (у птиц, некоторых рыб). В понятии СТМ, однако, не учтена возможность прямых стрессирующих воздействий на уже рожденных детенышей социального окружения, хищников и пр. (Если они оцениваются, то опосредованно через изменение поведения матери). О перинатальном стрессе говорят применительно к млекопитающим; рассмотрение ограничивается периодом, непосредственно предшествующим родам (поздним пренатальным), и коротким, следующим сразу за ними (неонатальным).
У человека перинатальный (околородовой) период исчисляется, начиная с 22-й полной недели (154-го дня) внутриутробной жизни плода по 7-й день после рождения ребенка.
Этими ограничениями и объясняется использование нами сравнительно редко употребляемого словосочетания “стресс в раннем онтогенезе”. Именно этот термин наиболее полно очерчивает круг явлений, представляющихся значимыми в попытке интерпретировать эффекты ранних стрессов с позиции их адаптивности.
Стрессоры в моделях изучения эффектов стресса в раннем онтогенезе
Повышенная анормальная активность ГГНС матери в период до рождения потомства или откладки яйца может быть обусловлена как различными внешними воздействия на материнский организм, так и внутренними причинами – устойчивыми болезненными состояниями матери. К стрессорам раннего постнатального периода относятся как внешние по отношению к системе “мать–потомство” негативные факторы, с которыми сталкиваются появившиеся на свет детеныши, так и измененное поведение матери (родителей), в первую очередь нарушенная (недостаточная) забота о потомстве. В экспериментальных исследованиях пренатального стресса обычно используют стандартизированные стрессоры, такие как иммобилизация (Fujioka et al., 1999; Darnaudéry, Maccari, 2008), иммобилизация в комбинации с ярким освещением (Frye, Orecki, 2002), звук (Coe et al., 1999), звук в комбинации со вспышками света (Fride, Weinstock, 1988), удар током (Fonseca et al., 2002), взятие в руки (Braastad et al., 1998) или более экзотические воздействия, такие как лишение сна (Suchecki, Palermo-Neto, 1991) или погружение в холодную воду (Drago et al., 1999).
Стандартизация воздействий важна при исследовании тонких механизмов программирования мозга, ГГНС, поведения. Однако эти стрессоры не имеют ничего общего с реальными ситуациями, с которыми животные сталкиваются в природе. Более реалистичны стрессоры социальной природы: помещение беременной самки в группу незнакомых животных (Coe, Crispen, 2000), периодические ссаживания с незнакомыми беременными самками (Marchlewska-Koj et al., 2003a, b), поражение при ссаживании на нейтральной территории (Stefanski et al., 2005), помещение в социальную среду с высокой плотностью (Crump, Chevins, 1989), добавление самцов и самок в группу (Zielinski et al., 1991), уплотнение с перемещением животных из группы в группу (Harvey, Chevins, 1987). Все эти манипуляции помимо эффектов прямых (не только агрессивных) взаимодействий означают нарушение стабильности социальной среды, резко увеличивают неопределенность, непредсказуемость ситуации, что само по себе является мощным фактором стресса (Von Holst, 1998). Нарушение стабильности социальной среды перемещением животных из группы в группу было успешно использовано при изучении последствий пренатального стресса в серии экспериментальных работ на морских свинках (Kaiser, Sachser, 1998, 2001; Kaiser et al., 2003а, b).
В исследованиях раннего постнатального стресса в качестве стрессоров используют разные варианты ранней социальной депривации: у приматов отлучение от матери и (или) от других членов группы (Harlow et al., 1971; Suomi, 1991; Winslow et al., 2003), у грызунов – различные формы изоляции от матери в сочетании со взятием в руки (различные варианты постнатальной социальной депривации у крыс и мышей подробно рассмотрены в статье Виинема (Veenema, 2009)).
В природе наиболее вероятными и наиболее изученными факторами стресса в период раннего онтогенеза являются хищники и обеспеченность ресурсами. Риск быть пойманным хищником увеличивается с ростом численности хищника и ведет к увеличению уровня адренокортикальной активности в организме самок (млекопитающие: Boonstra et al., 1998; Monclús et al., 2011; Sheriff et al., 2009, 2011; птицы: Saino et al., 2005; Love et al., 2008; Zanette et al., 2011; рыбы: McCormick, 1998; Giesing et al., 2011). Увеличение уровня стрессированности самок может быть прямым образом связано с уменьшением предсказуемости, качества и количества пищевых ресурсов (Kitaysky et al., 2007; Rogovin et al., 2008; Shultz, Kitaysky, 2008; Welckler et al., 2009). Повышенный уровень ГК самки может быть опосредован ухудшением ее состояния в связи с недостаточностью питания (Fraipont et al., 2000; Meylan et al., 2002; Love et al., 2009). Возможен и синергетический эффект взаимодействия факторов обеспеченности пищей и хищничества (Sheriff et al., 2010).
Социальные факторы также могут выступать в качестве стрессоров в природе. Это стресс, обусловленный ростом локальной плотности (классическая модель Кристиана – Christian, 1963, 1968, 1971, 1980) и внутригрупповыми отношениями (Sapolsky et al., 2000; Creel, 2001; Creel et al., 2013; Young et al., 2006). Агрессивные взаимодействия в конкурентной среде ведут к росту уровня ГК в организме самок (рыбы: МсCormick, 2006; пресмыкающиеся: Comendant et al., 2003; птицы: Love et al., 2008; млекопитающие: Kaiser, Sachser, 2005). В природной обстановке стрессорами, негативно влияющими на материнский организм, могут быть и климатические факторы (Wingfield, 2008), и влияние человека (Thiel et al., 2008; Wasser et al., 2011).
 В природе факторы, обусловливающие состояние материнского организма, действуют совместно. В ранний постнатальный период нарушения поведения самки (родителей), вызванные ее состоянием, недостатком пищевых ресурсов, присутствием хищников и пр., являются фактором стрессированности потомков, наряду с прямыми негативными воздействиями на них среды. В этом случае, однако, нельзя разделить следствия, связанные с недостаточностью питания или заботы, и прямые эффекты биотических и физических стрессоров (Sheriff, Love, 2013).
В природе факторы, обусловливающие состояние материнского организма, действуют совместно. В ранний постнатальный период нарушения поведения самки (родителей), вызванные ее состоянием, недостатком пищевых ресурсов, присутствием хищников и пр., являются фактором стрессированности потомков, наряду с прямыми негативными воздействиями на них среды. В этом случае, однако, нельзя разделить следствия, связанные с недостаточностью питания или заботы, и прямые эффекты биотических и физических стрессоров (Sheriff, Love, 2013).
Стресс и эпигенетическое программирование организма в раннем онтогенезе
Гормоны ГГНС играют важную роль в эпигенетическом программировании развития организма млекопитающего. В первую очередь такое программирование касается структурной организации головного мозга (McEwen, 2012). Мозг млекопитающих активно реагирует на хронические стрессовые нагрузки; в той или иной форме изменения отмечаются почти во всех отделах лимбической системы, включая поясную и зубчатые извилины, гиппокамп, миндалевидное тело (amigdala), гипоталамус (Hunter, 2012). На модельных видах грызунов (мыши, крысы) показано, что в области гиппокампа и медиальной префронтальной коры хронический стресс вызывает уменьшение длины дендритных окончаний, их ветвления и как следствие – сокращение площади синапсов. В этом, наряду с эффекторными аминокислотными трансмиттерами (гамма аминомасляная кислота, глицин и глутаминовая кислота), принимают самое непосредственное участие гормоны стресса – глюкокортикоиды.
В отличие от гиппокампа и префронтальной коры хронический стресс ведет к росту дендритных окончаний и увеличению синаптических связей в базолатеральной области миндалины и орбитофронтальной области коры, что обусловливает рост тревожности, настороженности и агрессивности (McEwen, 1999, 2007). Такие изменения обратимы, однако вероятность этого по выходе из стрессового состояния уменьшается с возрастом (Bloss et al., 2010). Сходные изменения возможны и вследствие стресса, который организм может испытывать в раннем онтогенезе (Weinstock, 2001, 2005, 2008). В развивающемся мозге структурные изменения в ответ на пренатальный стресс наблюдаются в префронтальной коре, миндалевидном теле, гиппокампе и гипоталамусе. Мозг запечатлевает стрессовые влияния эпигенетически путем включения механизмов метилирования цитозиновых оснований в промоторной зоне генов – рецепторов гормонов коры надпочечников (адренокортикоидов), либо путем модификации гистонов – белков, обслуживающих процесс транскрипции, или путем регуляции процесса трансляции мРНК малыми некодирующими молекулами РНК (Hunter, 2012; Hunter, McEwen, 2013).
Хотя эндокринное влияние матери у млекопитающих не исчерпывается гормонами ГГНС, их влияние изучено в наибольшей степени (McEwen, 2012; McEwen et al., 2012; Hunter, McEwen, 2013). Ниже мы лишь кратко охарактеризуем программирование мозга, ГГНС и поведения в пренатальный период, обусловленное влиянием гормонов ГГНС матери, а также программирование фенотипических качеств потомков в ранний постнатальный период, в котором ведущую роль играют родительские качества матери. Обсуждению механизмов программирования фенотипических особенностей потомства (морфологических, физиологических, поведенческих) посвящен ряд специальных обзоров (Seckl, 2004; Seckl, Meaney 2004; Meaney et al., 2007; Darnaudéry, Maccari, 2008; Weinstock 2001, 2005, 2008; McEwen, 2012; McEwen et al., 2012; Hunter, McEwen, 2013, и др.).
Пренатальное программирование
Существует большое число исследований лабораторных млекопитающих, свидетельствующих о влиянии материнского стресса (в основном на поздних стадиях беременности) на функционирование ГГНС и поведение потомков в зрелом возрасте (Schneider et al., 2002; Matthews et al., 2004; Kloet et al., 2005; Owen et al., 2005; Meaney et al., 2007; Weinstock, 2001, 2008). Гормоны стресса – глюкокортикоиды (ГК) играют важную роль в развитии мозга. Они взаимодействуют с внутриклеточными рецепторами двух типов, с высокоаффинными рецепторами глюкокортикоидов (ГР) и низкоафинными к ГК рецепторами минералокортикоидов (МР).
Эти рецепторы действуют как лиганд-активируемые транскрипционные факторы (Kloet et al., 1998). Активация ГР происходит с повышением уровня ГК в состоянии стресса и зависит от стадии суточного цикла (утром у людей, вечером и ночью у мышей и крыс). ГР широко представлены в разных отделах мозга – во фронтальной и поясной коре, гиппокампе, базолатеральном и базомедиальных ядрах миндалины, в таламусе, но особенно многочисленны в ядрах гипоталамуса и в гипофизе, где на них замыкаются основные контуры обратных связей ГГНС. Наиболее высокая концентрация МР характерна для гиппокампа (Kloet et al., 1998; Matthews, 1998). Избыточная экспозиция ГК или, наоборот, их недостаточность в период эмбриогенеза (модуляция в эксперименте) ведут к структурным и функциональным изменениям в мозге и в поведении (Sapolsky, 1987; Muneoka et al., 1997; Matthews, 2002). Так, показано, что пренатальная экспозиция ГК ведет к уменьшению представительства ГР и МР в гиппокампе, ослабляя механизм действия обратной связи ГГНС (Maccari et al., 1995, Van Waes et al., 2006). С этим связывают повышенный уровень ГК в организме взрослых потомков (Henry et al., 1994; Maccari et al., 1995; Levitt et al., 1996; Welberg et al., 2001; Welberg, Seckl 2001; Emack et al., 2008).
У млекопитающих в норме развивающийся плод защищен от эндогенных материнских ГК плацентарным барьером. У людей кортикотропин-релизинг гормон (КРГ) вырабатывается не только в мозге, но и плацентой (отличие приматов от грызунов, у которых плацентарный КРГ отсутствует; Weinstock, 2008). У беременных женщин плод оказывается защищенным от избытка материнского КРГ (Perkins et al., 1995). Уровень КРГ в плазме крови матери увеличивается в несколько раз в течение последнего триместра беременности, но гормон остается неактивным до тех пор, пока он соединен со связывающим белком (CRH-BP), уровень которого падает лишь к моменту родов. В результате увеличивается концентрация свободно циркулирующего КРГ, под действием которого ГГНС матери и плода продуцируют АКТГ и β-эндорфин (Chan et al., 1993).
В норме концентрации КРГ, АКТГ и β-эндорфина в плазме крови повышены в начале третьего триместра беременности (Wadhwa et al., 1996; Weinstock, 2005). Концентрация кортизола в крови матери также постепенно увеличивается и к концу третьего триместра беременности в 2–3 раза превышает таковую у небеременных. При этом концентрация кортизола в крови плода оказывается в 13 раз ниже, чем у матери (Gitau et al., 2001). Происходит это потому, что 80% его метаболизируется 11β-гидроксистероиддегидрогеназой-2 (11β-HSD2) до состояния неактивного кортизона в плаценте. 11β-HSD2 способна конвертировать и кортикостерон в инертный 11-дегидрокортикостерон, DH-B (Funder, 1996; Burton, Waddell, 1999; Seckl, 2004). Однако, в том случае, когда мать испытывает сильное воздействие стрессора, экспрессии 11β-HSD2 не происходит, либо она ослабевает (Lucassen et al., 2009). В результате развивающийся организм оказывается неспособным противостоять стрессирующему влиянию материнского организма.
Конкретные механизмы влияния материнских ГК на развитие мозга потомка все еще недостаточно исследованы. Хотя прямые мутагенные эффекты также существуют, эти механизмы в основном эпигенетические, определяющие изменения в экспрессии генов без изменения самих нуклеотидных последовательностей (Szif et al., 2008; McGowan, Szif, 2010a,b). Наиболее частым механизмом является метилирование ДНК и, как следствие, транскрипционные нарушения (Mueller, Bale, 2008; Peña et al., 2012; Matrisciano et al., 2013). Надежно показано, что обусловленное пренатальным стрессом програмирование мозга ориентировано по полу (Weinstock, 2007). Так, гиперметилирование цитозиновых оснований в области промотора ГР 1-7 в гиппокампе и гипометилирование рецептора КРГ в гипоталамусе и центральной зоне миндалины было обнаружено у подвергавшихся пренатальному стрессу самцов мышей, но не наблюдалось у самок. Эти различия в реакции полов коррелировали с экспрессией ряда генов в плаценте (Mueller, Bale, 2008). Другой механизм связан с участием miRNA – малых некодирующих молекул РНК, влияющих на процесс трансляции. Показано, что эти эффекты сохраняются и во втором поколении потомков (Morgan, Bale, 2011).
Дифференцированные по полу эффекты материнского стресса подробно исследованы на крысах. Пренатальный стресс вызывает повышение уровня кортикостерона в эмбриональном мозге самцов, ведет к феминизации мозга и поведения. Под действием кортикостерона в развивающемся мозге самцов крыс снижается концентрация тестостерона и фермента ароматазы (обеспечивает превращение тестостерона в эстрадиол), меняется активность катехоламинов, происходит уменьшение размера диморфного по полу ядра преоптической области (SDN-POA) и истончение отдельных участков коры. Проблемы с обучаемостью, замедление нейрогенеза и долгосрочной симпатической трансмиссии (hippocampal long termed potentiation, LPT) в гиппокампе, редукция плотности дендритных шипиков в префронтальной коре более выражены у пренатально стрессированных самцов, в то время как синдромы тревожности, депрессии и повышенная реактивность ГГНС к воздействию стрессоров более выражены у пренатально стрессированных самок. Гендерные различия существуют в чувствительности развивающегося мозга к гормонам стресса (Weinstock, 2007). В целом у грызунов гендерные различия в структуре и функционировании мозга и поведении в результате влияния материнских ГК сохраняются и во взрослом состоянии, но в измененном виде (Catalani et al., 2011).
Вейнсток (Weinstock, 2005, 2008) подробно проанализировала факторы, с которыми может быть связана вариабельность результата пренатального программирования качеств потомства у грызунов. У крыс и мышей каждый из факторов, таких как природа и время экспозиции стрессора во время беременности, возраст, в котором проводится тестирование потомков в отношении эффектов материнского стресса, генетические особенности исследуемых линий, а также пол потомка, обусловливал фенотипические эффекты испытанного в пренатальный период стресса. К этому необходимо прибавить влияние на результат времени суток, в которое проводилось тестирование ГГНС потомков. Результат оценки материнского эффекта зависел от того, исследовали ли у потомков фоновый уровень глюкокортикоидов или уровень глюкокортикоидов в ответ на воздействие стрессора. Кроме того, существует вариабельность пороговых уровней реагирования развивающегося плода на стресс матери как на индивидуальном, так и на видовом (генетические линии) уровнях. Для возникновения эффекта воздействие стрессора должно быть достаточно длительным и интенсивным. Как правило, последствия наиболее выражены, если материнский организм подвергался воздействию стрессора на поздней стадии беременности. Это связано со временем формирования структур мозга, рецепторов и системы функциональных связей в мозге и организме в целом. У разных видов эти структуры и связи формируются в разное время.
С этим связана видоспецифичность эффектов материнского стресса (Weinstock, 2008). Таким образом, обусловленное материнским стрессом пренатальное программирование потомства у млекопитающих (по-видимому, подобная схема существует и у других позвоночных) включает цепь событий от влияния стрессоров на организм матери, эндокринных взаимодействий организма матери с организмом плода с участием плаценты, до эпигенетических изменений в организме потомка. Материнское неблагополучие в период беременности ведет к повышению материнского ГК сигнала, к уменьшению экспрессии ГР у развивающегося плода и к повышенному уровню ГК у потомка. Соответственно меняется порог реагирования организма потомка на стрессоры.
Постнатальное программирование
Степень завершенности развития (созревания) мозга и ГГНС относительно даты рождения различается у разных модельных видов млекопитающих. У приматов, жвачных, морских свинок формирование мозга и нейроэндокринной системы заканчивается в основном к моменту рождения. Однако у мышей, крыс, кроликов эти процессы продолжаются и в раннем постнатальном (неонатальном) периоде жизни (Weinstock, 2008).
Еще в 50-е годы ХХ в. стало известно, что многократное взятие в руки детенышей крыс и мышей в отдельные периоды неонатального развития (действие, моделирующее усиленную родительскую заботу) снижает стрессируемость в ответ на воздействие стрессоров в последующей жизни (Levine, 1957, 1960; Denenberg, Karas, 1959). С тех пор накоплено большое количество свидетельств тому, что степень связи с матерью, ее заботливость в ранний постнатальный период влияет на экспрессию рецепторов глюкокортикоидов, чувствительность к стрессорам и изменяет поведение потомков в стрессовых ситуациях (Francis, Meaney, 1999; Meaney, 2001; Meaney et al., 2007).
Так, подросшие потомки самок крыс, больше заботившихся о детенышах, демонстрировали во взрослом состоянии повышенную экспрессию ГР в гиппокампе, отличались повышенной функциональной активностью контура отрицательной обратной связи ГГНС и имели более сдержанный по сравнению с контролем ответ на воздействие стрессоров (Liu et al., 1997). Во взрослом состоянии такие потомки демонстрировали высокий уровень заботы о детенышах. Экспериментальные манипуляции с перекладыванием детенышей от заботливых матерей к незаботливым и наоборот показали, что замена родной матери на чужую в первый день постнатальной жизни реверсивно меняет фенотип детенышей в соответствии с тем, какая самка воспитывает детенышей.
Это свидетельствует о прямой связи тренда развития ГГНС и поведения потомков с качеством материнской заботы (Francis et al., 1999; Meaney, 2001). Эксперименты с перекладыванием (cross-fostering) детенышей также показали, что именно стресс в пренатальный период обусловливает изменения у потомков. В условиях постнатального стресса наиболее частым механизмом регуляции активности генов является метилирование ДНК, однако наряду с этим описан механизм, основанный на модификации гистонов – белков, обслуживающих процесс танскрипции (Hunter, McEwen, 2013). Так, материнская забота способна влиять на степень метилированности ДНК в промоторе гена ГР в гиппокампе (Weaver et al., 2004).
Это происходит в результате ингибирования байндинг-активности транскрипционного фактора NGFI-A, обеспечивающего экспрессию ГР (Weaver et al., 2004, 2005, 2007). Присутствие метилированных нуклеотидов в местах связывания узнаваемых NGFI-A транскрипционных факторов с нуклеотидной последовательностью ГР-промотора вызывает остановку транскрипции под действием РНК-полимеразы (наблюдается снижение экспрессии мРНК). Нуклеотидные последовательности в зоне промотора ГР характеризуются более низким уровнем метилированности у потомков, матери которых были более заботливыми, и наоборот уровень метилированности ДНК был более высоким у потомков плохих матерей. Более высокий уровень метилированности ДНК в зоне промотора гена ГР обусловливал снижение количества ГР, приводил к меньшей стресс-реактивности и более медленному восстановлению после прекращения действия стрессора у взрослых животных.
Эти различия, проявившиеся уже на первой неделе жизни, оказались, однако, обратимыми, когда детенышей от заботливой матери перекладывали к малозаботливой (cross-fostering experiment), и наоборот. В дальнейшем изменения сохранялись во взрослом состоянии. Если же в мозг детенышей незаботливых матерей вводили трихостатин А (ингибитор гистондиацетилазы, обеспечивает более открытую конфигурацию хроматина и способен интенсифицировать транскрипцию), а в мозг детенышей заботливой самки вводили метионин (донор метильной группы, усиливающий метилирование ДНК в присутствии метилтрансферазы), различия между группами по уровню метилированности ДНК, связанности NGFI-A с промотором ГР, ГР-экспрессии и реактивности ГГНС в ответ на стрессоры исчезали.
То, что “хорошее” материнское поведение может компенсировать негативные последствия пренатального стресса, известно из других исследований. Беременные самки крыс, подвергавшиеся воздействиям стрессоров на последней неделе беременности, демонстрируют ухудшенное материнское поведение выкармливания. Однако если сравнить стрессированных потомков крыс, выращенных нестрессированными матерями, с нестрессированными потомками, выращенными стрессированными во время беременности самками, то оказывается, что материнская забота со стороны нестрессированных матерей способна компенсировать негативное влияние пренатального стресса на родительские качества дочерей вне связи с гормональными или нейрональными перестройками в период эмбрионального развития.
Таким образом, не только пренатальный стресс, но и качество материнской заботы в ранний постнатальный период влияют на поведенческий фенотип потомка (Del Cerro et al., 2010). Свидетельства эпигенетической регуляции в мозге в связи с качеством родительской заботы и другими стрессирующими воздействиями в ранний постнатальный период жизни получены и другими группами исследователей (Murgatroyd et al., 2009; Roth et al., 2009; McGowan et al., 2011). Одним из стрессирующих факторов может выступать социальное окружение, влияющее на нейрогенез в мозге мышей (Branchi et al., 2006). Экспериментальные исследования свидетельствуют о том, что особенности взаимодействия детенышей с матерью в ранний постнатальный (неонатальный) период жизни играют важную роль в программировании функциональных связей мозга, ГГНС, способности реагировать на стрессирующие воздействия среды в течение взрослой жизни.
Высокое качество материнской заботы, связанное часто с низким уровнем стрессированности матери, обусловливает надежное функционирование контуров обратных связей ГГНС, замкнутых на богато представленные в структурах мозга рецепторы глюкокортикоидов, и, соответственно, обусловливает низкий уровень стрессированности у потомков.
Популяционные последствия стресса в раннем онтогенезе
1. Классический период популяционной экологии
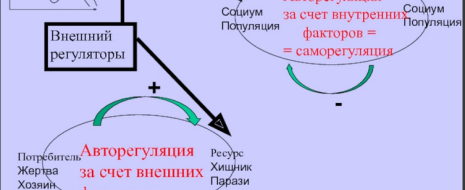
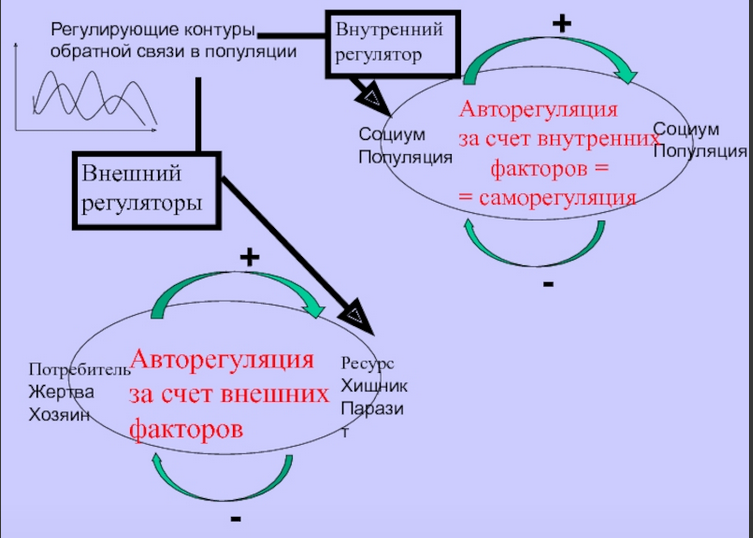
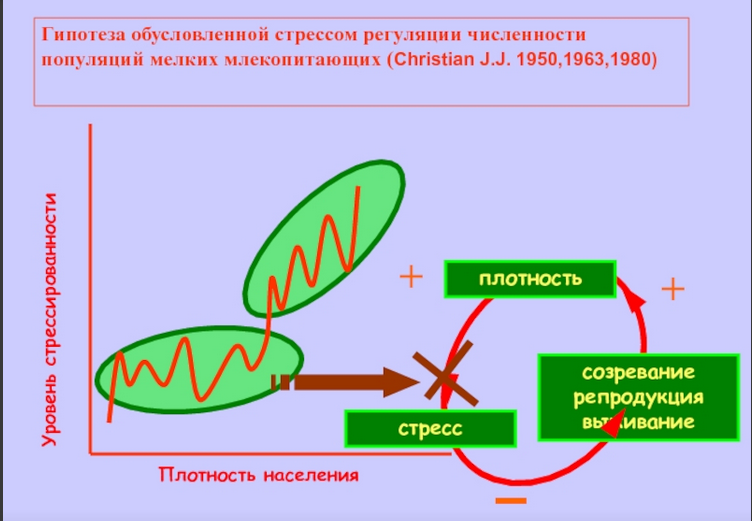
Гипотеза материнского эффекта и популяционные циклы численности. Гипотеза авторегуляции, основанная на физиологических эффектах в сфере отношений матери и потомства, была высказана еще в 80-е годы прошлого века (Ward, 1984; Lee, McDonald, 1985). В сущности она представляла собой расширительное толкование гипотезы обусловленной стрессом авторегуляции популяционной плотности Кристиана (Christian, 1950, 1963; Christian, LeMunyan, 1958) и предсказывала возможность регуляции популяционной плотности млекопитающих через определяемые условиями развития детенышей изменения их поведения в пре- и постпубертатном возрасте, в первую очередь в сфере репродуктивного поведения и пространственной активности (характер использования территории, способность к расселению). Предполагалось, что социогенный стресс (обусловленный избыточной плотностью социальной среды) может сказываться как на развитии плода, так и на развитии и темпах роста детенышей в постнатальный период, внося дополнительный вклад в снижение численности наряду с торможением репродуктивных функций и повышенной, обусловленной стрессом, смертностью.
Исследований, свидетельствующих о торможении роста, задержке созревания в условиях повышенной плотности населения существовало достаточно много (Marchlewska-Koj, 1997). Хорошим примером исследований этого периода может служить сравнительный анализ взаимозависимости между динамикой популяционной плотности, темпами полового созревания и адренокортикальной активности у красных полевок в оптимуме и пессимуме ареала (Евсиков, Мошкин, 1994; Novikov, Moshkin, 1998). В оптимуме ареала на пике популяционной плотности было отмечено полное подавление полового созревания сеголеток и максимальная адренокортикальная активность у полевок разного пола и возраста. При содержании молодых животных, отловленных в начале лета, в отдельных клетках темпы созревания в сезоны максимальной популяционной плотности возрастали, а при низкой плотности в природе замедлялись (Novikov, Moshkin, 1998). Более детальные исследования с контролем формирования отдельных структур ГГНС были выполнены на копытных леммингах (Dicrostonyx torquatus), у которых на пике популяционной плотности было отмечено торможение пренатального и постнатального развития нейросекреторных ядер гипоталамуса, участвующих в регуляции гипофизарно-надпочечниковой и гипофизарно-гонадной систем (Аршавская, Данилова, 1987; Аршавская и др., 1987; Ткачев и др., 1987; Владимирова и др., 1996). Высокие показатели эмбриональной и ювенильной смертности копытного лемминга, установленные на стадиях пика и спада численности (Ткачев и др., 1987), связывались с низким уровнем развития гипоталамо-гипофизарного комплекса.
Предполагалось, что более раннее формирование механизмов гипоталамического контроля вегетативных и эндокринных функций должно обеспечивать у леммингов необходимый уровень зрелости и лабильности адаптивных реакций у плодов и новорожденных. Это подтверждалось данными о незначительной эмбриональной смертности на стадиях с низкой плотностью популяции (Ткачев и др., 1987). Безусловным достижением работ популяционных экологов второй половины и конца прошлого века было продуктивное соединение знаний о вызываемых стрессом, в том числе СТМ, нарушениях развития (созревания) организма с наблюдаемыми особенностями динамики численности и демографическими изменениями в популяциях.
Эти работы имели отчетливую эволюционную направленность и рассматривали стресс как популяционную адаптацию, обеспечивающую настройку популяционной системы к модальным условиям ее существования (Шилов, 1984). Вместе с тем трактовки роли стресса как фактора, регулирующего динамические процессы в популяциях, выглядели скорее как гипотезы, нежели имели под собой количественные оценки приспособленности особей (выживаемость, репродуктивный успех), испытавших на себе стрессовые нагрузки разной модальности. Кроме того, наблюдения в природе не давали возможности судить о самостоятельной роли последствий стресса в раннем онтогенезе в регуляции популяций вне связи с общими, легко наблюдаемыми эффектами хронического стресса, ведущими к подавлению репродукции, иммунной системы, истощению, нарушению пищеварения и т.д. Новый подход обозначился в самом конце прошлого – начале нынешнего веков, когда начинают использоваться индивидуально ориентированные наблюдения и эксперименты в природе или в условиях, моделирующих природные ситуации. Важную роль в становлении нового подхода сыграла теория оптимизации распределения репродуктивного вклада в потомство (sex allocation theory; Charnov, 1982).
2. Оптимизация распределения репродуктивного вклада в потомство и пренатальный стресс
У ряда видов наземных позвоночных животных сильные, здоровые матери рождают больше сыновей в отличие от матерей со слабым или нарушенным здоровьем, у которых соотношение полов в выводках смещено в сторону преобладания дочерей. Объяснением этого явления может служить модель, предложенная Триверсом и Уиллардом (Trivers, Willard, 1973) как составная часть более общей теории оптимизации соотношения полов через распределение репродуктивного вклада в потомство (sex allocation theory; Charnov, 1982; West, 2009). Основная идея гипотезы Триверса и Уилларда состоит в том, что при плохих условиях выгоднее вкладывать в дочерей, поскольку шанс размножения самки даже в пессимальных условиях достаточно высок, а “плохие” сыновья будут неконкурентоспособными и вероятность их размножения низка. Напротив, при хороших условиях существования выгоднее вкладывать в сыновей, поскольку здоровые сыновья имеют большую репродуктивную ценность, чем здоровые дочери (Trivers, Willard, 1973; Frank, 1990). Существует довольно много свидетельств того, что стрессовая среда и соответственно СТМ (пренатальный стресс) смещает соотношение полов в сторону преобладания самок.
Так, яйцекладущие самки ящерицы (Uta stansburiana), получавшие экзогенные глюкокортикоиды (кортикостерон) из имплантов в силиконовой оболочке, формировали более богатые энергоресурсами яйца, из которых вылуплялись относительно более крупные самки, однако это не касалось самцов (Sinervo, DeNardo, 1996). У европейского скворца инъекции кортикостерона в свежеотложенные яйца приводили к вылуплению самок более высокого качества по сравнению с контролем, но это не касалось вылупившихся самцов. Самцы из инъецированных кортикостероном яиц появлялись на свет более мелкими, медленнее росли и отличались повышенной смертностью в раннем возрасте, несмотря на то, что в норме у европейского скворца самцы крупнее самок (Love, Williams, 2008a). У потомков самок крыс, подвергавшихся в период беременности социогенному стрессу (чрезмерная плотность группы), наблюдалась феминизация поведения сыновей, сокращение у них ано-генитального расстояния по сравнению с контрольной группой, но у самок видимые изменения поведения на протяжении эстрального цикла отсутствовали (Dahlöf et al., 1977).
У беличьих саймири, самки которых в период беременности испытывали пренатальный стресс (помещение в чужую группу), у сыновей наблюдались признаки иммуносупрессии. Концентрация иммуноглобулина IgG у сыновей падала, в то время как у дочерей, напротив, увеличивалась (Coe et al., 2000). Признаки инфантилизации сыновей и маскулинизации дочерей были подробно исследованы у морских свинок (Kaiser, Sachser, 2005; Sachser et al., 2011; подробнее см. ниже). Связь пренатального стресса как высокой, так и средней модальности со смещенным в сторону преобладания самок соотношением полов при рождении была показана в популяциях людей (Peterka et al., 2004; Obel et al., 2007). Не исключено, что более частое рождение девочек в некоторых странах является следствием стрессов, испытываемых матерями в период беременности (Obel et al., 2007). Результаты приведенных выше исследований (перечень примеров может быть продолжен) поддерживают гипотезу Триверса и Уилларда (Trivers, Willard, 1973) и свидетельствуют в пользу приспособительного значения смещения соотношения полов у потомков, матери которых испытывали стресс.
Существует, однако, немало исследований, в которых интерпретировать последствия пренатального стресса как благоприятствующие дочерям и негативные в отношении сыновей, либо как положительные в отношении потомков одного пола и отрицательные – другого пола, в чистом виде не удается (Allen, Haggett, 1977; Harvey, Chevins, 1984, 1985, 1987; Zielinski et al., 1991; MarchlewskaKoj et al., 2003a, b; Kaiser, Sachser, 2005, и др.). Эти исследования проводились в условиях лаборатории на немногих модельных видах млекопитающих. Результаты этих работ, даже если и демонстрируют в той или иной степени признаки феминизации или инфантилизации сыновей и маскулинизации дочерей (либо отсутствие того или другого), в основном свидетельствуют о нарушении нормального полового развития, о замедлении темпов полового созревания. В этих исследованиях эффектов пренатального стресса внимание, как правило, сосредоточено на программировании мозга, функциональных связей ГГНС или поведения (Weinstock, 2005, 2007, 2008; Glover et al., 2010; McEwen et al., 2012). Сравниваемые признаки потомков в опыте и контроле в этих работах могут иметь весьма отдаленное отношение к реальным индикаторам приспособленности самцов и самок, рожденных матерями, испытавшими пренатальный стресс.
Кроме того, возможны и иные причины нарушения эмбрионального соотношения полов. У водяной полевки (Arvicola terrestris) преобладание в помете самцов, а не самок может быть связано с низкой энергообеспеченностью матерей и, как следствие, повышенной эмбриональной смертностью дочерей (Назарова, Евсиков, 2000; Назарова, 2008). Авторы рассматривают это явление как адаптивное, поскольку снижается вероятность рождения низкокачественных самок матерями низкого качества (качества, определяющие успешность выкармливания потомства, наследуются дочерьми: h2 = 0.64).
3. Эпигенетическое программирование морфофункциональных и поведенческих качеств потомства у рыб
3.1. Рыбы коралловых рифов, социальная конкуренция и трэйдоффы между выживаемостью и смертностью
Рыбы тропических рифов обитают в условиях высокого разнообразия видов и высокой плотности населения в период размножения и поэтому представляют собой удобную модельную группу для изучения внутри- и межвидовых, обусловленных социальной средой влияний материнских глюкокортикоидов (СТМ) на фенотипическую изменчивость и приспособленность потомства (McCormick, 1998).
У тропической рыбы-ласточки (Pomacentrus amboinensis) из сем. Pomacentridae самцы охраняют придонные гнезда, в которые откладывают икру находящиеся поблизости самки. Между самками существуют иерархические отношения. Большая часть отложенной икры принадлежит доминирующей самке. Часть самок икру не откладывает. Однако общая плотность самок, взаимодействующих с размножающимися самцами, положительно влияет на уровень кортизола в организме последних. Повышенный уровень кортизола материнского организма обусловливает появление из икры мелких личинок (McCormick, 1998, 2006); при этом объем желтка в желточном мешке остается неизменным (Gagliano, McCormick, 2009). Во время пелагической стадии, которую проходят личинки (между 15 и 23-м днями), наблюдается интенсивная, зависящая от размера особи смертность, причем наибольшей выживаемостью характеризуются личинки мелкого размера, но с относительно большими желточными мешками (Gagliano et al., 2007).
При высокой локальной плотности рыб выселение из мест рождения имеет несомненные выгоды, но требует в целом более выносливой личинки, т. е. большого резерва желтка, дающего возможность длительного пребывания в состоянии пелагической стадии. Таким образом, в противоположность мнению о том, что “быть большим всегда выгодно”, опосредованная плотностью индуцированная глюкокортикоидами редукция размера вышедшей из икринки личинки адаптивна, поскольку сочетается с относительно большими резервами желтка. И наоборот, больший размер, высокие темпы роста личинки на начальной стадии формирования сообщества увеличивают выживаемость (Holmes, McCormick, 2006; Gagliano et al., 2007), вероятно, за счет снижения уязвимости таких мальков для хищника (gape limited predation). Участки с низкой плотностью рыб и редкими социальными взаимодействиями населены самками с низкой глюкокортикоидной реакцией.
Эти самки производят мальков большего размера (McCormick, 1999, 2006), для которых сокращение дистанции расселения представляется выгодным. Таким образом, у рыбы-ласточки действует плотностнозависимый механизм, оптимизирующий расселение и пополнение локальной популяции (сообщества) наиболее конкурентоспособными рыбами. Эти же работы содержат результаты, указывающие на то, что для реалистичной объективной оценки адаптивной ценности индуцированных материнским эффектом изменений в размерных и других характеристиках потомков, приспособленность должна оцениваться на протяжении всей жизни особи. Влияния пренатальной среды, которая индуцировала фенотипические изменения у потомков, безусловно, велико, но не только пренатальная среда определяет индивидуальную приспособленность.
3.2. Трехиглая колюшка и хищники – формирование адаптивного профиля поведения мальков путем модификации развития икры под влиянием материнского стресса
В исследовании Гизинга с соавторами (Giesing et al., 2011), выполненном на трехиглой колюшке (Gasterosteus aculeatus), имитировалось нападение хищника – щуки (Esox lucius) – на рыбок экспериментальной группы один раз в день в разное время суток. Оказалось, что подвергавшиеся угрозе нападения самки откладывали более крупную икру с повышенным содержанием кортизола. Такие икринки потребляли больше кислорода сразу после оплодотворения по сравнению с контрольными (в контроле самки, отметавшие икру, атакам хищника на стадии формирования и созревания икры не подвергались). Мальки, вышедшие из икры, отложенной самками, подвергавшимися нападению щуки-модели, предпочитали держаться более плотной группой. Такое поведение экспериментальной группы мальков адаптивно, поскольку обеспечивает лучшую защиту молоди от хищников (Magguran, 1990; Queiroz, Magurran, 2005). При этом материнский эффект не сказывался на соматическом росте мальков (Giesing et al., 2011). Реакция самок колюшки на присутствие хищника также влияла на способность потомства к обучению (Roche et al., 2012). Из четырех гормонов материнского происхождения в икре колюшки уровни прогестерона, тестостерона и эстрадиола резко снижались после оплодотворения икры и оставались на низком уровне.
Однако уровень кортизола снова поднимался на восьмой день после оплодотворения (Paitz et al., 2015). Изменение уровня стероидов было обусловлено эмбриональными процессами, менявшими первичную эндокринную среду эмбриона. Эндокринные изменения эмбриональных стадий подтвердили способность материнских стероидов влиять на развитие организма потомков. Проведенные исследования показали, что воздействие экологически значимого стрессора на самку трехиглой колюшки во время формирования икры имеет далеко идущие последствия для потомства. Некоторые из этих эффектов могли быть опосредованы воздействием кортизола, уровень которого повышался в организме самки под воздействием хищника. Вопрос, в какой мере глюкокортикоидный профиль материнского организма определяет глюкокортикоидный профиль подросшего потомства, исследовали в специально поставленном эксперименте. В этом случае охоту хищника моделировали сначала применительно к самкам-матерям, а потом уже применительно к их подросшей молоди (Mommer, Bell, 2013).
Хотя потомство матерей, подвергавшихся воздействию хищника, отличалось по глюкокортикоидному ответу от потомства контрольных матерей в ситуации предъявления хищника потомству, оказалось, что глюкокортикоидная реакция потомков на хищника в значительно большей степени определялась полом и социальной средой. Среди потомства самки имели более высокий уровень кортизола, чем самцы, а рыбы в группе имели более низкий уровень кортизола, чем рыбы, которые были изолированы от конспецификов. В совокупности результаты этих исследований однозначно свидетельствуют в пользу того, что самки трехиглой колюшки могут адаптивно влиять на развитие, рост и поведение потомства, обеспечивая соответствие его качеств вызовам среды в будущем.
Однако необходимо иметь ввиду, что это соответствие возможно лишь в случае совпадения текущих (в период вынашивания икры) и будущих условий, в которых будет жить следующее поколение. Если особи трехиглой колюшки, матери которых подвергались атакам хищника, сталкивались с реальным хищником – живой щукой – один на один, то они чаще становились жертвами щуки по сравнению с потомками матерей, не имевших опыта общения с хищником (McGhee et al., 2012). Кроме того, выживаемость молодых колюшек зависела от их размера. Чем более крупными были колюшки, рожденные матерями, подвергавшимися воздействию хищника, тем более уязвимыми при столкновении с щукой один на один они оказались по сравнению с потомками матерей, не имевших опыта общения с хищником (McGhee et al., 2012). Таким образом, опыт встречи с хищником может иметь долгосрочные последствия для потомства, но их адаптивность зависит от контекста.
3.3. Родительская забота у рыб и социальное поведение потомков: программирование нейроэндокринной оси стресса у цихлид Neolamprologus pulcher
Регуляция экспрессии глюкокортикоидных рецепторов в раннем онтогенезе – возможный механизм вариации социальной конкурентоспособности (social competence). Группа исследователей под руководством Барбары Таборски (Nуman et al., 2018) проверила эту гипотезу на социальной цихлидовой рыбе Neolamprologus pulcher. Мальки этой цихлиды подращивались с участием и без участия родителей. Молекулярный механизм, транслирующий ранний социальный опыт на зрелые стадии жизненного цикла, у рыб в общих чертах гомологичен таковому у млекопитающих (Steenbergen et al., 2011). Рыбки N. pulcher, воспитывавшиеся с родителями, имели более выраженную экспрессию гена глюкокортикоидного рецептора (ГР1) в переднем мозге. При этом уровни экспрессии гена транскрипционного фактора реакции раннего роста 1 (eGR1 – transcription factor of early growth response 1) были связаны с экспрессией ГР1 в переднем мозге и гипоталамусе. (Ген транскрипционного фактора eGR1 является маркером нейрональной активности и пластичности и сам кодирует транскрипционный фактор, который, как предполагается, активирует в дальнейшем гены кортикостероидной оси стресса в дорзолатеральной области переднего мозга рыб (Desjardins, Fernald, 2010)).
Блокирование глюкокортикоидных рецепторов антагонистом мифепристоном (RU486) приводило к тому, что выращенные родителями рыбки демонстрировали более социально адекватное, субмисcивное поведение в случаях, если оказывались на территории более крупных конспецификов. Эти рыбки реже бывали атакованы хозяевами территории, а в конечном счете оказывались более успешными в овладении территорией. Результаты этого исследования показали, что ранняя социальная среда программирует нейроэндокринную ось стресса у рыб (Taborsky et al., 2013; Nyman et al., 2017) подобно тому, как это происходит у млекопитающих (Wingfield, Sapolsky, 2003; Kaiser, Sachser 2005; Weinstock, 2008; Steenbergen et al., 2011; McEwen, 2012) и птиц (Banerjee et al., 2012; Zimmer, Spencer, 2014).
4. Плотность населения ящериц и филопатрия
Исследования ящериц, связавшие повышенную гормональную активность ГГНС размножающихся самок с фенотипическими эффектами, наблюдаемыми у молодняка, внесли значительный вклад в формирование представлений о возможной адаптивной роли последствий СТМ (Dufty et al., 2002). В исследовании, выполненном Синерво и ДеНардо (Sinervo, DeNardo, 1996), самкам яйцекладущей ящерицы (Uta stansburiana) вводили экзогенные глюкокортикоиды (кортикостерон) с помощью имплантов в силиконовой оболочке. Это не влияло на размер кладки, однако вело к формированию более богатых энергоресурсами яиц и вылуплению более крупных самок, но не самцов. При этом индуцированное имплантированным кортикостероном изменение текущих репродуктивных затрат вело к снижению выживаемости самок-матерей. Направление эффекта зависело от плотности населения ящериц в текущем году (Sinervo, DeNardo, 1996). Поскольку концентрация кортикостерона в плазме крови размножавшихся самок ящериц была положительно связана с плотностью населения, было высказано предположение о том, что увеличение размеров вылупившихся молоденьких самок адаптивно, поскольку способствует выживанию молодняка в условиях жесткой конкуренции со взрослыми ящерицами (Comendant et al., 2003).
В другом исследовании у живородящей обыкновенной ящерицы (Lacerta vivipara) наблюдался отрицательный гормонально обусловленный материнский эффект в отношении молодых самцов; самцы рождались более мелкими, имели худшие экстерьерные признаки и медленнее росли. При этом у них наблюдалась более высокая выживаемость (Meylan, Clobert, 2005; Coté et al., 2006). Кроме того, у потомков, рожденных старыми ящерицами, отличавшимися худшими экстерьерными качествами и повышенным уровнем глюкокортикоидов, наблюдалась склонность к филопатрии (Fraipont et al., 2000; Meylan et al., 2002). Авторы предположили, что хронический подъем уровня глюкокортикоидов в организме самки во время беременности служит сигналом, свидетельствующим о низкой вероятности выживания матери после появления на свет молодых ящериц. Это в конечном счете обеспечивает меньшую напряженность конкуренции между родителями и потомством (Meylan, Clobert, 2005). Таким образом, уровень глюкокортикоидов в организме матери может влиять на динамические процессы как в локальной популяции, так и в мета-популяции в целом, влияя на формирование пополнения и другие процессы жизненного цикла (Meylan et al., 2012).
5. Европейский скворец и гипотеза “комплементарности материнского качества и требований потомства” (Matternal Match Hypothesis)
Интересный цикл исследований был проведен учеными из Канады и США в естественной популяции европейских скворцов (Sturnus vulgaris) в Канаде (Love et al., 2005; Love, Williams 2008a, b; Love et al., 2013). Эксперимент в природе был спланирован таким образом, что позволял одновременно манипулировать фенотипом потомства через стресс организма матери и условия жизни, с которыми птенцам предстоит столкнуться после появления на свет.
Известно, что эмбриональные эффекты избыточных глюкокортикоидов материнского организма, как правило, снижают качество потомства. Однако, согласно идее авторов исследования, эффект может повышать совокупную приспособленность самки в случае комплементарности качества материнского организма и требований появившегося на свет потомства. Основной вопрос формулировался следующим образом: при каких условиях и в какой мере индуцированные материнским стрессом особенности потомства у европейского скворца могут быть полезными их матерям?
Кортикостерон инъецировали прямо в желток свежеотложенных яиц, моделируя таким образом эффект избыточных глюкокортикоидов (ГК) материнского организма. Помимо этого экспериментально меняли материнскую способность эффективно выкармливать птенцов. Предполагалось, что самки низкого качества, с высоким фоновым уровнем глюкокортикоидов, хуже выкармливают птенцов по сравнению с самками высокого качества, у которых фоновая “стрессированность” ниже. Отрицательная связь между родительскими качествами матери и базальным уровнем ГК материнского организма была показана ранее (Love et al., 2005; Love, Williams, 2008b).
Кроме того, уровень ГК материнского организма был положительно связан с уровнем ГК в яичном желтке (Love et al., 2005). Разнокачественность самок моделировали путем обрезания некоторых перьев в оперении на стадии выкармливания птенцов (Love, Williams, 2008a). В эксперименте были использованы четыре группы птиц:
1) птенцы, вылупившиеся из яиц, инъецированных раствором кортикостерона в кунжутовом масле, и их матери с обрезанными перьями,
2) птенцы, вылупившиеся из яиц, инъецированных кортикостероном, и их матери с необрезанными перьями,
3) птенцы, вылупившиеся из яиц, инъецированных чистым кунжутовым маслом, и матери с обрезанными перьями и
4) контрольные, без инъекции, птенцы с их полноценными матерями.
Далее исследовали, как ГК-индуцированное качество птенцов и качество их матерей влияют на плодовитость и выживаемость матерей в будущем. Экспериментально модулированный уровень желточных ГК вызывал связанный с полом трейдофф между количеством и качеством потомства. Повышение уровня кортикостерона в яйцах обусловливало более высокое качество дочерей. Напротив, самцы европейского скворца, в норме более крупные и быстро растущие по сравнению с самками, вылуплялись более мелкими, медленнее росли и отличались повышенной смертностью в раннем возрасте. Однако когда самцов, подвергшихся воздействию материнского стресса (инъекция кортикостерона в яйцо), выкармливали матери низкого качества (с обрезанными перьями), те из самцов, кто выжил, превзошли контрольных самцов по ряду фенотипических показателей-индикаторов приспособленности (Love, Williams 2008a; Chin et al., 2009).
Хотя матери, у которых потомки испытали воздействие материнского стресса, выращивали меньшее число детей в текущем цикле размножения, соответствие качества матери требованиям потомства приносило матерям пользу в будущем. Самки в конечном счете извлекали выгоду из совокупного успеха размножения вследствие трейдоффов между текущими репродуктивными затратами матери и 1) ее будущим состоянием, 2) ее будущим репродуктивным вкладом, 3) выживаемостью. Конкретно, самки низкого качества, как бы испытывавшие хроническую стрессовую нагрузку (оценивалась косвенно через ухудшение эффективности фуражировки и кормления птенцов в результате обрезания перьев) и вырастившие потомство, испытавшее воздействие экзогенных глюкокортикоидов,
1) находились в лучшем состоянии по экстерьерным показателям во время вторых выводков,
2) в будущем производили большее число потомков лучшего качества и
3) отличались более высокой выживаемостью в последующие годы (межгодовые сравнения; Love, Williams, 2008a).
Таким образом, анализ соответствия фенотипических характеристик потомства качеству материнской заботы продемонстрировал увеличение материнской совокупной приспособленности, несмотря на то, что некоторые из ответных реакций потомков в краткосрочной перспективе (снижение размера и темпов роста) выглядели неадаптивными (Love, Williams, 2008a).
Европейский скворец – не единственный среди воробьиных птиц пример адаптивных фенотипических изменений у потомков, матери которых подвергались стрессирующим воздействиям. В эксперименте в природе с большими синицами (Parus major), самкам которых предъявляли хищника, птенцы, выращенные другими родителями (не подвергавшимися риску нападения), отличались от контрольных кросс-фостеров меньшими размерами и весом. Интересно, что у первых быстрее развивались крылья, что, с точки зрения авторов исследования, возможно обеспечивало им больше шансов для выживания (Coslovsky, Richner, 2011). Концентрация тестостерона в яйцах от самок, испытавших риск нападения хищника, была более низкой по сравнению с контролем. Различия по андростенону и прогестерону в желтке отсутствовали (Coslovsky et al., 2012). Однако известно, что именно тестостерон желтка влияет на темп роста и развития.
Пониженный уровень тестостерона в желтке мог быть обусловлен гормонами стресса, концентрацию которых в данном исследовании не измеряли. Опосредованное стрессом изменение уровня тестостерона в желтке могло модулировать дифференцированное развитие морфологических структур.
6. Влияние нестабильной социальной среды во время беременности на развитие потомков у морских свинок
Морская свинка была одомашнена в Южной Америке где-то между 6000 и 3000 лет назад. Несмотря на это, поведение домашней морской свинки (Cavia aperea f. porcellus) в общих чертах сходно с поведением дикого предка, C. аperea. Различия касаются в основном частоты проявления паттернов и порогов включения тех или иных форм поведения (Künzl, Sachser, 1997; Sachser, 1998). Социальные взаимодействия у домашних морских свинок отличаются большей дружелюбностью, а система иерархических связей при содержании группой более мягкая. При содержании в неволе самцы диких свинок крайне агрессивны по отношению к молодым созревающим самцам (вплоть до их гибели). Среди молодых самок складывается строгая линейная иерархия с доминированием старшей самки. Дикие морские свинки отличались в 5–7 раз более высоким уровнем адреналина и норадреналина в сыворотке крови в ответ на взятие в руки при сходном уровне кортизола (Künzl, Sachser, 1997).
Обширный цикл исследований влияния стресса в раннем онтогенезе на развитие мозга, формирование нейроэндокринных связей и поведения был выполнен группой немецких ученых на одомашненных морских свинках (Кaiser, Sachser, 2005, 2009; Sachser et al., 2011). В качестве стрессора в период раннего онтогенеза использовалась нестабильность социальной среды. Социально стабильные группы свинок состояли из пяти самок и одного самца. Социальная нестабильность в группе в период беременности и лактации обеспечивалась пересаживанием части самок из группы в группу (каждые три дня заменяли двух самок в группе). Было показано, что биосоциальные стимулы оказывают на морских свинок разнообразные нейроэндокринные эффекты (Hennessy, 1988; Sachser et al., 1994, 1998). В частности, нестабильная социальная среда в период беременности (пренатальный стресс) значимо влияла на развитие эндокринной системы, мозга и поведения потомства, причем это влияние было специфичным в отношении пола (Sachser, Kaiser, 1996; Kaiser, Sachser, 1998, 2001; Kaiser et al., 2003a, b).
Дочери самок, которые во время беременности испытали влияние социальной нестабильности, отличались от контроля (беременность протекала в социально стабильной среде) ярко выраженными признаками “поведенческой маскулинизации”. Для них были характерны позы и движения ухаживания, характерные для полового поведения самца, а также игровое поведение в период взрослой жизни (Sachser, Kaiser, 1996; Kaiser, Sasher, 1998; Kaiser et al., 2003a). Поведенческая маскулинизация дочерей сопровождалась повышенным уровнем тестостерона и повышенной адреномедулярной активностью, о чем свидетельствовала повышенная активность тирозингидроксилазы мозгового вещества надпочечников (Kaiser, Sachser, 1998). Дочери, матери которых подвергались в период беременности влиянию нестабильной социальной среды, демонстрировали типичную для самцов экспрессию рецепторов андрогенов в медиальной преоптической области мозга (MPOA) и дугообразном ядре (Nucleus arcuatus, ARC) гипоталамуса (Kaiser et al., 2003a). Кроме того, у дочерей, чьи матери имели опыт жизни в нестабильной социальной среде во время беременности, было обнаружено усиление рецептора андрогенов в CA1-зоне гиппокампа, а также рецептора эстрогена-α (ER-α) в MPOA, ARC и CA1 (Kaiser et al., 2003a).
В отличие от пренатально стрессированных самок самцы, матери которых жили в нестабильной социальной среде, демонстрировали особенности поведения, характерные для молодых самцов – тесные телесные контакты во время отдыха. У пренатально стрессированных самцов эта особенность сохранялась до более взрослого возраста. Кроме того, типичное половое поведение самцов (позы и движения ухаживания) часто оказывалось интегрированным в игровое поведение (Kaiser, Sachser, 2001). Таким образом, поведение пренатально стрессированных самцов имело черты инфантильного. Поведенческая инфантилизация (behavioral infantilization, Kaiser, Sachser, 2001) была связана с отсроченным развитием адренокортикальной системы и пониженной активностью симпатической адреномедулярной системы (Kaiser, Sachser, 2001). Самцы, чьи матери имели опыт жизни в нестабильной социальной среде, имели пониженную экспрессию рецепторов андрогенов в MPOA, ARC гипоталамуса, а также ER-α в CA1-зоне гиппокампа (Kaiser et al., 2003b).
Возможность трактовки результатов этих исследований как адаптивных по мнению авторов обоснована тем, что популяционная плотность морских свинок в природе варьирует в широких пределах (Sachser, 1998), а социальная организации меняется в зависимости от плотности (Sachser, 1986). Предполагалось также, что высокая популяционная плотность сопряжена с социальной нестабильностью (Von Holst, 1998). Какое приспособительное значение может иметь маскулинизация дочерей? Авторы исследования дают следующий ответ (Кaiser, Sachser 2005; Kaiser, Sachser 2009; Sachser, Hennessy, Kaiser, 2011). Самка морской свинки, живущая в условиях высокой плотности в социально нестабильной среде, эпигенетически программирует развивающийся организм потомка, подготавливая его к жизни в условиях высокой плотности. Маскулинизация дочерей адаптивна в плотных поселениях, поскольку самки становятся более конкурентоспособными в условиях дефицита пищевых ресурсов и убежищ (Кaiser, Sachser, 2005). Однако максулинизация поведения одновременно ухудшает и будущие репродуктивные качества самки.
Таким образом, в условиях высокой плотности действует трейдофф между маскулинизированным фенотипом на эндокринном и поведенческом уровнях и платой за снижение репродуктивного успеха. В условиях же низкой популяционной плотности более выгодно инвестировать ресурсы времени и энергии в репродуктивное усилие, нежели поддерживать более конкурентоспособный в дефицитной по обеспеченности пищей среде маскулинизированный фенотип. Для сыновей же, рожденных испытавшими пренатальный стресс самками, в условиях высокой плотности более выгодно иметь менее выраженные признаки самца, в особенности в период, сопряженный с половым созреванием. Начальный период половой зрелости у самцов сочетается с напряженными социальными взаимодействиями, с частыми травмами при изменении позиций в системе социальных связей. В это время молодые самцы у морских свинок подвергаются жесткому агрессивному давлению со стороны взрослых самцов в борьбе за возможность размножения и вынуждены эмигрировать за пределы социума.
В норме морские свинки созревают в возрасте 2–3 мес (Webster, Young, 1951). С этим возрастом связано резкое увеличение агрессивных контактов у молодых самцов в присутствии рецептивной самки (Sachser, 1986). При низкой плотности самки максимизируют собственную приспособленность, пренатально программируя сыновей к раннему созреванию (раннее прекращение периода инфантильности). Напротив, в условиях повышенной популяционной плотности при наличии структурированной по возрастам социальной среды замедление созревания сыновей выгодно как матерям, так и их сыновьям. В этих условиях более 85% детенышей в экспериментальных разновозрастных группах домашних морских свинок принадлежат высокоранговым самцам (Sachser, 1998). При этом молодые самцы не созревают до возраста 7 мес и избегают агонистических взаимодействий в молодом возрасте (Sachser, 1993).
В противном случае их репродуктивный успех был бы ниже того, который они смогут иметь в будущем. Половое созревание и социальная зрелость у морских свинок не вполне совпадают во времени. В результате поведенчески инфантильные, хотя уже и созревшие самцы, реже подвергаются атакам со стороны самца-доминанта (Sachser, Renninger, 1992). Таким образом, пренатальное программирование сыновей матерями, которое выражается в меньшей экспрессии признаков самца и отсроченном созревании, обеспечивает им оптимальную репродуктивную стратегию в условиях высокой плотности населения.
Резюмируя итоги приведенных выше экспериментальных исследований одомашненных морских свинок, нельзя не отметить умозрительность и излишний адаптационизм трактовок авторами результатов. Так, предполагается, что самки при высокой плотности более конкурентоспособны в соревновании за ресурсы пищи, что адаптивно; они же при высокой плотности меньше вкладывают в потомков, которые обречены на гибель; таким образом, самки экономят ресурсы для будущего размножения – тоже адаптивно. Однако сам по себе отказ от размножения в стрессовой среде мало о чем говорит без демонстрации того, что совокупная приспособленность таких самок увеличивается.
7. Американский заяц-беляк (Lepus americanus) и 10-летний цикл в системе “хищник–жертва”
Среди свободноживущих млекопитающих яркий пример влияния материнского стресса (СТМ) на параметры физиологии и поведения жертвы, находящейся под влиянием хищника, численность которого меняется во времени, предоставляет американский заяц-беляк (Sheriff et al., 2009, 2010, 2011). Для популяций зайцев характерны регулярные циклические колебания численности с интервалом от 8 до10 лет между пиками (Krebs et al., 1995). Численность популяции хищника (в основном это американская рысь) отстает от численности популяции жертвы на 1–2 года. В периоды падения численности зайцев большинство из них гибнет от хищников. После окончания фазы падения численности популяция зайцев продолжает оставаться в состоянии глубокой депрессии еще от 2 до 5 лет (восстановление не начинается), несмотря на низкую численность хищников и хорошую обеспеченность зайцев кормом (Krebs et al., 1995).
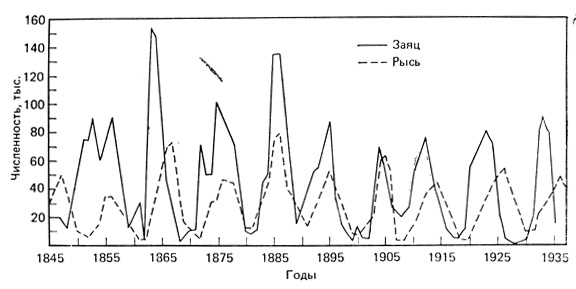
Изменения численности рыси и зайца-беляка, регистрируемые по числу шкурок, заготовленных Компанией Гудзонова залива. Это классический пример циклических колебаний плотности популяций. (Рисунок из работы MacLulich, 1937). Источник. Одум, 1986.
Максимально успешное размножение зайцев происходит на начальной стадии восстановления их численности, когда численность хищников минимальна; успешность размножения зайцев прогрессивно снижается в течение фазы падения их численности, достигая состояния минимума при максимальной численности хищников. Успех размножения зайцев остается минимальным до конца фазы депрессии (окончание фазы низкой численности; Krebs et al., 1995). Во время фазы спада численности вызовы среды (направления воздействия факторов) в отношении матерей и их потомков совпадают. Высокий риск нападения хищника обусловливает повышенный уровень стрессированности матерей, о чем свидетельствует высокий уровень глюкокортикоидов в материнском организме (Sheriff et al., 2011). С высоким материнским стрессом связано уменьшение размера выводков и рождение зайцами более мелких детенышей (Sheriff et al., 2009).
Эта связь прослежена как в природе, так и в эксперименте. Более того, экспериментально показано, что пренатально-стрессированные зайчата отличаются более высоким уровнем глюкокортикоидов и более интенсивной реакцией на стрессоры по сравнению с зайчатами, не подвергавшимися влиянию СТМ. Под влиянием СТМ зайчата становятся более пугливыми и настороженными. Такое изменение поведения зайчат способствует увеличению их выживаемости (Sheriff, Love, 2013). Поведенческие особенности сохраняются и во взрослом возрасте (Sheriff et al., 2010). Одновременно более низкая успешность текущего размножения самок коррелирует в условиях высокой вероятности нападения хищника с их лучшей выживаемостью в основном за счет сокращения времени на поиск и добывание корма. При этом продолжительность периода активности самок сокращается за счет времени, когда атака хищника наиболее вероятна.
В фазе роста численности популяции зайца направления воздействия факторов среды на зайчих и на их потомство также совпадают. Эти вызовы среды определяются низким риском быть убитым хищниками (хищников еще мало) и высоким обилием пищи (численность зайцев еще низка). В этих условиях уровень глюкокортикоидов у беременных зайчих низкий. Они рождают крупных зайчат с низкой стресс-реакцией на хищника. В результате в этой фазе движения численности приспособленность зайчих высокая. Принципиально иная ситуация складывается в начале фазы депрессии. В этот период движения численности популяции американского зайца-беляка наблюдается несовпадение (mismatch) вызовов среды в отношении беременных зайчих и их потомков (матери испытывали повышенный стресс от хищников в конце фазы падения численности, а их потомки уже испытывают низкий пресс хищников в фазе депрессии). Зайчихи производят на свет выводки меньшего размера и более мелких детенышей с повышенной стресс-реактивностью. Эта ситуация не адаптивна.
Комбинация эффектов вследствие несоответствия вызовов, предъявляемых средой матерям в период беременности, и вызовов среды обитания их потомства является, по мнению авторов исследования, основной причиной задержек восстановления численности зайцев, т.е. затяжных, до 5 лет, периодов депрессии, когда численность хищников уже низка, а ресурсы пищи в избытке (Sheriff, Love, 2013). Этот лаг, удлиняющий цикл численности, характерен не только для американских зайцев-беляков, но и для популяций полевок (Boonstra et al., 1998). Индуцированная СТМ неадаптивная фенотипическая изменчивость в начальный период депрессии численности может быть объяснением затяжных периодов депрессии численности и у других видов млекопитающих.
Таким образом, индуцированные СТМ фенотипические особенности потомства, проанализированные с учетом средовых контекстов, свидетельствуют в пользу адаптивных преимуществ СТМ фенотипов, однако лишь в случае, когда вызовы среды в отношении матерей и потомков совпадают, и наоборот – о неадаптивности эффектов материнского стресса, если такое соответствие отсутствует (Sheriff, Love, 2013).
8. Последствия пренатального стресса у людей: патологии или адаптации
Стресс, испытываемый матерью во время беременности, оказывает разнообразные долговременные эффекты на детей, которые в современных условиях жизни проявляются как разного рода нарушения (в развитии мозга, психофизиологии, поведении и т.д.) (Talge et al., 2007; Beydoun, Saftlas, 2008; Wadhwa et al., 2009, и др.). Различные психопатологии у таких детей включают избыточную тревожность (increased anxiety; Van den Bergh, Marcoen, 2004; Bergman et al., 2007; Bruijn et al., 2009, и др.), дефицит внимания или гиперактивность (attention deficit/hyperactivity disorder (ADHD): O’Connor et al., 2002a; Obel et al., 2003a; Rodriguez, Bohlin, 2005; Van Den Bergh, Marcoen, 2004), кондуктивные расстройства, антисоциальные проявления, включающие повышенную агрессивность (conduct disorders: O’Connor et al., 2002b; Van den Bergh, Marcoen, 2004; Bruijn et al., 2009; Rice et al., 2010); ухудшение когнитивных способностей (Bergman et al., 2007; Laplante et al., 2008; Mennes et al., 2006, и др.), нарушенное кросс-доминирование правой и левой рук (more mixed handedness: Obel et al., 2003b; Glover et al., 2004; Rodrigues, Waldenstrom, 2008).
Кроме того, имеют место различные нарушения функционирования ГГНС (O’Connor et al., 2005; Yehuda et al., 2005; Huizink et al., 2008; Van Den Bergh et al., 2008; Entringer et al., 2009). Отмечено более редкое рождение сыновей, что является, по-видимому, следствием перераспределения репродуктивного вклада в потомков в пользу дочерей как более перспективного пола в условиях стресса (Peterka et al., 2004; Obel et al., 2007). Не исключено, однако, что многочисленные изменения, которые имеют вид патологий в настоящем, в эволюционном масштабе времени могли иметь приспособительное значение. В биомедицинских исследованиях идея о том, что развитие плода должно происходить в направлении адаптации к среде, в которой ему придется существовать, встречается в ряде работ (Gluckman et al., 2005, 2007; Glover, 2011). Гловер (Glover, 2011) специально рассматривает проблему постнатальных психопатологий в эволюционной перспективе. Хотя некоторые из предлагаемых ею объяснений могут показаться тенденциозно адаптационистскими, в целом эволюционный подход автора заслуживает внимания, поскольку по-новому расставляет акценты в традиционных биомедицинских исследованиях.
Гловер считает, что в контексте эволюционного подхода становится более понятным, почему синдром повышенной тревожности, но не депрессия у матерей в период беременности, имеет более выраженный эффект у детей, почему повышенная тревожность и симптомы ADHD – наиболее частые эффекты пренатальных стрессов, почему депрессивные состояния и повышенная тревожность у детей проявляются при разных модальностях пренатальных стрессовых состояний матери и т.д. (O’Connor et al., 2002b; Field et al., 2003). Очевидно, эпигенетическое программирование организма ребенка организмом матери в период эмбриогенеза (fetal programming, FP) идет различным образом в зависимости не только от стадии беременности, в которой организм матери испытывал стресс (соответствие времени формирования структур и функциональных связей в развивающемся организме), но и от природы материнского стресса. Тщательное изучение условий и FP возможно сможет помочь объяснить, почему некоторые психопатологии развития персистируют в популяциях человека. Не исключено, что в определенных обстоятельствах эволюционного прошлого было выгодным иметь в популяции долю индивидов с повышенной тревожностью, способных быстро переключать внимание, менять схемы поведения или быть более агрессивными. Так, ADHD синдром при рассмотрении его в контексте эволюционного прошлого человечества мог означать способность быстро перестраивать внимание в насыщенной опасностями среде, которая была стрессовой и для матери, и для ее потомков.
Повышенная восприимчивость к сигналам слабой модальности, к новым звукам предупреждала о приближении хищника или врага. ADHD синдром означал повышенную готовность к исследованию и освоению новой среды, что тоже было важным этапом прогрессивной эволюции человека (Glover, 2011). Гиперактивность и импульсивность означают непредсказуемость поведения. В изменчивой среде такое поведение отдельных индивидов в составе родового социума могло быть полезным (Williams, Taior, 2006). То же относится к синдрому повышенной тревожности в результате пренатального стресса. Повышенная тревожность (anxiety) в эволюционной истории человека означала повышенную настороженность (vigilance) и быстроту поведенческой реакции в условиях постоянной опасности, а также возможность подготовиться к оптимальному реагированию на стрессор средней интенсивности (Marks, Nesse, 1994).
Кондуктивные расстройства могли означать повышенную готовность к освоению новой среды, более легкому (эмоционально) преодолению опасностей, избеганию хищников; повышенная агрессивность могла означать повышенную конкурентоспособность. Пониженные когнитивные способности ассоциированы с рассеянным вниманием, неспособностью концентрироваться на чем-то одном (distracted attention). Существуют свидетельства связи аутизма детей с пренатальным стрессом. Но помимо нарушения способности к социализации аутизм – это еще и особый способ мышления. Нельзя исключить, что аутичные индивиды с синдромом средней модальности обладали когнитивными способностями, имевшими в эволюционном прошлом определенную выгоду. Наконец, измененная структура связей ГГНС означает изменение в порогах реагирования на стрессоры, которые очевидно были иными, чем в современном мире.
Конечно, такого рода объяснения на самом деле объяснениями не являются. И если одни из них могут быть приняты в качестве рабочих гипотез, имеющих пусть косвенные, но свидетельства в их пользу (например, результаты изучения поведения настороженности (vigilance) у млекопитающих в природе; Quenette, 1990), то другие – чисто умозрительны, и объяснений, почему аутизм мог быть полезен в прошлом, можно придумать немало. Основная проблема состоит в том, что отсутствует или крайне ограничена возможность оценки “адаптивности” последствий пренатального стресса у детей в эксперименте. И все же работа в направлении поиска возможностей для экспериментальной проверки некоторых гипотез, как и поиск косвенных свидетельств значимости в эволюционном прошлом приобретенных в раннем онтогенезе нарушений поведения представляется оправданной. Древняя наследственная компонента стереотипов нашего эмоционального реагирования, разного рода фобий несомненно существует. Так, если рассматривать фобии взрослых людей, то очень непросто убедить человека не бояться змей, но гораздо труднее заставить его бояться автомобилей (Marks, Nesse, 1994).
Адаптивный потенциал стресса периода раннего онтогенеза
Проблема адаптивности последствий стресса раннего онтогенеза неразрывно связана с теорией “конфликта интересов родителей и потомков” (parent-offspring conflict theory: Trivers, 1974; Godfray, 1995; Parker et al., 2002), в рамках которой баланс интересов ближайших потомков и родителей решается в терминах затрат и выигрыша в ближней и отдаленной перспективе. По мнению Маршалла и Уллера (Marshall, Uller, 2007), в большинстве случаев конфликт интересов матери и потомков на интервалах времени, соизмеримых с продолжительностью жизни матери, решается в ее пользу вне зависимости от того, увеличивает или снижает материнский эффект выживаемость или успех размножения ее ближайших потомков. Иными словами, материнский эффект в масштабе цикла текущего размножения может как увеличивать приспособленность потомков, т.е. быть адаптивным для них, так и уменьшать их приспособленность (неадаптивный эффект). Однако совокупная приспособленность матери в течение жизни может расти как за счет успешности будущего размножения матери, так и за счет будущего размножения отдельных выживших потомков.
Оценка полезности материнского эффекта непосредственно для ближайшего потомства, т.е. индуцированной матерью адаптивной фенотипической изменчивости потомства, возможна лишь тогда, когда исследователь располагает данными об изменчивости окружающей среды во времени или в пространстве (если расселяющийся молодняк меняет условия своего обитания), когда условия окружающей среды для потомства предсказуемы относительно фенотипа матери и условий среды ее жизни, а затраты на передачу материнского сигнала или перераспределение ресурсов сравнительно низкие и, следовательно, напряженность конфликта интересов матери и интересов потомства не высока. Применительно к обсуждаемой нами проблеме адаптивности последствий стресса раннего онтогенеза фенотипически проявляющиеся у потомков последствия ранних стрессов могут быть полезными для них в случае соответствия требованиям среды, с которыми потомки столкнутся в своей дальнейшей жизни.
Это возможно лишь в том случае, если требования среды, в которой существовал организм матери в период формирования яйца или беременности и сразу после рождения выводка, совпадут с требованиями среды жизни ее потомков (Love et al., 2005; Love, Williams, 2008a; Sheriff, Love, 2013; Sheriff et al., 2009, 2010). В тех же случаях, когда условия среды обитания матери и ее потомства не совпадают, СТМ обусловливает неадаптивные фенотипические изменения у потомков, снижающие их приспособленность (Sheriff et al., 2009, 2010). При этом последствия СТМ, снижающие приспособленность потомства, могут быть выгодны для матери, поскольку оптимизируют ее затраты на текущее размножение, и в конечном счете могут повышать ее совокупную приспособленность (Love, Williams, 2008a). Правильная оценка адаптивной значимости СТМ возможна, таким образом, лишь в масштабе не отдельного цикла размножения, но всего жизненного цикла матери (integrated life history perspective, Sinervo, DeNardo, 1996).
Возникает вопрос, насколько реален адаптивный вектор в пре- и постнатальном программировании потомков, если рассматривать это явление в эволюционном масштабе времени? Может ли стресс, испытываемый в раннем онтогенезе, обеспечивать основу и задавать направление эволюционных преобразований? Множество исследований свидетельствует о росте фенотипической и генетической изменчивости при стрессе. Эта изменчивость служит материалом для формирования новых адаптаций (Шмальгаузен, 1968; Shapiro, 1992; Jablonka, Lamb, 1995; Hofman, Parsons, 1997, и др.). Стрессовая среда дестабилизирует и модифицирует интегрированную генетическую систему (Sharloo, 1991). Помимо мутагенных эффектов стресс, дестабилизируя систему онтогенеза, обусловливает фенотипическое проявление аккумулированной скрытой генетической изменчивости (Беляев, 1979, 1983; Беляев, Бородин, 1982; Bradshaw, Hardwick, 1989; Gibson, Wagnerr, 2000; Badyaev, 2005; Bijlsma, Loeschcke, 2005, и др.).
При стрессах периода раннего онтогенеза возникающие в результате пре- и раннего постнатального программирования фенотипические модификации, обусловленные эпигенетическими механизмами, также вносят существенный вклад в формирование фенотипического разнообразия, создавая дополнительные возможности для отбора. Благораря пластичности формирующихся структур и функций в процессе индивидуального развития организма пре- и постнатальное программирование дает возможность онтогенетической системе приспособиться к стрессовой среде. При этом индуцированная ранними стрессами изменчивость не случайна, но определенным образом канализирована (Badyaev, 2005). Эта канализированность вызванных стрессами раннего онтогенеза изменений задана онтогенетической системой и, сама являясь результатом предшествующей эволюции, служит одним из факторов быстрых эволюционных изменений в предсказуемо изменяющейся стрессовой среде (Badyaev, 2005). В предсказуемо флуктуирующей среде она может служить объяснением существования альтернативных сценариев онтогенеза.
Не исключено, что СТМ выступал, а возможно и сейчас выступает в качестве модификатора эволюционно обусловленной программы онтогенеза, запускаемой сигнальными факторами среды (развитие и созревание по быстрому или медленному сценариям) у сезонно размножающихся грызунов в зонах с умеренным и холодным климатом (Новиков, Мошкин, 2009). Эта же канализированность вызванной ранними стрессами вариабельности может обусловливать быстрые эволюционные изменения в случае однонаправленных изменений среды. Обусловленные эпигенетически, повторяющиеся модификации сохраняются в следующих поколениях, могут накапливаться в популяции и поддерживаемые отбором постепенно закрепляться на генетическом уровне. Так, трансгенерационные эффекты СТМ могут способствовать генетической ассимиляции стресс-индуцированных эффектов (Badyaev, 2009; Badyaev, Uller, 2009).
Вполне вероятно, что у видов с разным образом жизни в основе эволюционно детерминированных различий реагирования на стрессоры социальной природы лежали эпигенетические механизмы развития фенотипических проявлений стресса раннего онтогенеза. Чувствительность к стрессорам в постнатальной жизни потомков стрессированных матерей может быть как более высокой (низкий порог реагирования; Sherif, Love, 2013), так и пониженной (высокий порог реагирования; Дыгало и др., 1990). Не исключено, что повышение порога чувствительности к стрессорам и модификация поведения в направлении к большей социальной терпимости в условиях повышенной плотности социальной среды в фазе роста и пика численности популяции давала возможность относительно безболезненно переносить агрессивные проявления со стороны других членов социума. Повышенная устойчивость к социогенным стрессорам у одиночных, некооперативно размножающихся видов млекопитающих могла оказаться первым шагом на пути формирования семейно-группового образа жизни (Попов, 2011). Известно, что у кооперативно размножающихся видов с наиболее устойчивыми системами доминирования-подчинения повышенный уровень глюкокортикоидов в большей степени свойственен особям, способным выдерживать высокие стрессовые нагрузки. Именно они становятся доминантами, определяющими структуру социальных связей в группе (Creel, 2001; Creel et al., 2013).
Напротив, у одиночных, некооперативно размножающихся видов, более высокая стрессированность чаще встречается у субординантных особей. Случаи подавления репродуктивной функции стрессом описаны в основном у тех млекопитающих, для которых репродуктивная кооперация не характерна (Creel, 1996, 2001; Creel et al., 2013).
Заключение
Идея об обусловленной стрессом матери экономии затрат на текущее размножение не нова. В качестве выгоды для матери исследования классического периода популяционной экологии рассматривали возможность сохранения репродуктивного потенциала матери для ее размножения в будущем (Роговин, Мошкин, 2007). В качестве выгоды для потомства у быстро созревающих грызунов рассматривался отказ от размножения в текущем сезоне за счет развития по медленному сценарию, обеспечивающему лучшую подготовку к переживанию неблагоприятных зимних условий (Оленев, 1981, 2002; Новиков, Мошкин, 2009).
Возникает вопрос, что нового дают современные проверки адаптивности последствий стресса раннего онтогенеза по сравнению с трактовками классического периода популяционной экологии? Исследования раннего периода, если проводили в природе, то на кротких временных интервалах, и они имели характер констатации факта наличия связи между гипотетическим стрессфактором и его последствиями. Результаты лабораторных экспериментов, в которых моделировали стрессовые ситуации, в том числе хронические, и оценивали их последствия (отказ от размножения, торможение развития и созревания потомства, его повышенная смертность и пр.), экстраполировали на природные ситуации (Роговин, Мошкин, 2007). Действенным инструментом современных исследований адаптивности последствий стресса раннего онтогенеза у животных стал эксперимент в природе или в условиях, моделирующих природные (Sinervo, DeNardo, 1996; Lowe et al., 2005; Love, Williams, 2008a, b; Giesing et al., 2011, и др.).
Такие исследования остаются немногочисленными. Их инструментарий нельзя считать вполне сформированным. Однако уже сейчас обозначились общие особенности подхода.
1. Обязательный мониторинг судьбы поколений родителей и потомства (Sheriff, Love, 2013). Долговременные эксперименты в природе дают возможность оценить приспособленность как матерей, испытывавших и не испытывавших повышенную стрессовую нагрузку, так и их потомков на фоне меняющихся условий жизни. Конечно, прямая оценка приспособленности через успех размножения (по числу потомков, достигших половой зрелости и вступивших в размножение) при работе с природными популяциями во многих случаях невозможна. Однако косвенные количественные оценки через выживаемость или успешность рекрутирования потомков в социум в сочетании с экспериментальными манипуляциями дают информацию, позволяющую делать статистически обоснованные заключения. Хорошо известно, что чувствительность к воздействию стрессоров меняется в течение жизненного цикла (Wingfield et al., 1998; Wingfield, Ramenofsky, 1999; Romero, 2002; Sherif, Love, 2013).
Мониторинг последствий стресса раннего онтогенеза на больших интервалах времени важен еще и потому, что постнатальная среда жизни (качество материнской (родительской) заботы, опосредованной изменившимися условиями кормообеспеченности, климата, прессом хищников) может компенсировать эффекты пренатальной среды (Sherif, Love, 2013).
2. Обязательный учет условий жизни матери и потомства. В отличие от лабораторного эксперимента эксперимент в природе не дает возможность стандартизировать условия опыта и контроля настолько, чтобы исключить их влияние на результат. Однако существует возможность оценить влияние факторов статистически, путем использования методов множественных сравнений, таких как общие линейные (GLM) и обобщенные (GLZ) модели. Последние позволяют анализировать как линейные, так и нелинейные эффекты.
Социальный и средовой (хищники, обеспеченность ресурсами, климат) контексты, собственное состояние матери (статус здоровья, обеспеченность организма ресурсами), предсказуемость среды на отрезках времени, соизмеримых с жизнью двух (в идеале и более двух) поколений, напряженность конфликта интересов родитель–потомок (соотношение затрат на формирование определенного фенотипа потомка и выгод от этого фенотипа) – все эти переменные могут влиять на проявление последствий ранних стрессов, и их следует принимать в расчет при планировании исследования. Поскольку в природе такие стрессоры, как плотность социальной среды, хищники и обеспеченность пищей могут оказаться сильно связанными и их эффекты невозможно разделить, эксперименты в приближенных к естественным условиях могут иметь преимущества, поскольку дают возможность технически исключить влияние отдельных факторов и манипулировать другими (Creel et al., 2013).
3. Необходимым условием экспериментов в природе и в условиях, приближенных к естественным, является подбор адекватных стрессоров, т.е. таких, с повреждающим воздействием которых животное реально сталкивается в своей жизни, а их эффекты укладываются в границы нормы реакции исследуемого вида (популяции).
4. На сегодня существует крайне мало экспериментальных моделей – видов, на которых проводятся исследования. Однако результаты, полученные на небольшом числе видов, однозначно свидетельствуют о важной роли видовой специфики развития фенотипических проявлений стресса, испытанного организмом в раннем онтогенезе.
Ощущается явный недостаток в исследованиях видов с разным образом жизни. Исследования стресса периода раннего онтогенеза, в которых акцентировано внимание на его механизме, и выполненных на модельных видах грызунов, во многих случаях свидетельствуют о нарушении функционирования ГГНС. Aномально повышенный уровень ГК в организме матери как правило ведет к редукции рецепторов ГК и МК в мозге, к нарушению функционирования регуляторных контуров обратной связи в организме потомка и, как следствие, к повышенной продукции ГК в ответ на стрессоры (Matthews 2002; Weaver et al., 2004; Bogoch et al., 2007).
Вместе с тем известна отрицательная зависимость адренокортикальной реакции потомков крыс на эмоциональный стресс от уровня ГК в организме их матерей (Дыгало, Науменко, 1983). На примере природной популяции водяной полевки была показана значимая отрицательная корреляция межгодовых изменений кортикостероидной реакции сеголеток с динамикой ГК в крови беременных самок (Евсиков и др., 2001). Противоречие в результатах этих работ требует более при стального изучения механизмов с учетом видовой специфики реагирования и, возможно, связано с тем, что сам по себе повышенный базальный или обусловленный стрессором уровень ГК в организме потомка еще не означает автоматически изменения порога реагирования органов-мишеней, в частности мозга, и поведения на стрессоры.
В заключение нашего обзора следует добавить, что в теоретическом плане при сопоставлении с ранее распространенными взглядами на популяционную роль стресса как популяционной адаптации (Шилов, 1982, 1984) с их предрасположенностью к сомнительной идеологии группового отбора (Wynne-Edwards, 1962) современные интерпретации остаются всецело в рамках парадигмы естественного отбора, точкой приложения которого всегда является особь. В практическом плане эволюционно-экологический подход в изучении последствий ранних стрессов может быть полезным для понимания процессов формирования здоровья и будущих функциональных расстройств человека. В конечном счете возникает надежда на то, что будет наконец достигнуто понимание необходимости сокращения несоответствия между пренатальной и будущей средой жизни человека, несоответствия, существенно повышающего риски заболеваний в зрелом возрасте (Wadhwa et al., 2009; Heindel et al., 2016).
Список литературы
Аршавская Т.В., Данилова О.А., 1987. Ультраструктура срединного возвышения и задней доли гипофиза новорожденных копытных леммингов при спаде численности популяции // Арх. анатомии, гистологии и эмбриологии. Т. 93. Вып. 9. С. 37–43.
Аршавская Т.В., Владимирова Е.Г., Данилова О.А., 1987. Особенности дифференцировки нейрогемальных отделов нейросекреторной системы новорожденных копытных леммингов на разных стадиях популяционного цикла // Журн. эволюц. биохимии и физиологии. Т. 23. С. 765–770.
Беляев Д.К., 1979. Некоторые генетико-эволюционные аспекты стресса и стрессируемости // Вестн. АМН СССР. No 7. С. 9–14.
Беляев Д.К., 1983. Дестабилизирующий отбор // Развитие эволюционной теории в СССР (1917–1970-е годы). Л.: Наука. Ленингр.отд-ние. С. 266–277.
Беляев Д.К., Бородин П.М., 1982. Влияние стресса на наследственную изменчивость и его роль в эволюции // Эволюц. генетика. Л.: Наука. Ленингр. отдние. С. 35–59.
Владимирова Е.Г., Данилова О.А., Черниговская Е.В., 1996. Характеристики формирования гипоталамо-гипофизарной нейросекреторной системы у арктических леммингов Dicrostonix torquatus острова Врангеля в постнатальный период развития // Журн. эволюц. биохимии и физиологии. Т. 32. Вып. 3. С. 308–317.
Дыгало Н.Н., 2007. Психонейроэндокринные свойства взрослого организма предопределяются особенностями экспрессии генов в раннем онтогенезе // Рос. физиол. журн. им. И.М. Сеченова. Т. 93. No 11. С. 1229–1236.
Дыгало Н.Н., Науменко Е.В., 1983. Роль глюкокортикоидов матери во время беременности в определении реакции гипофизарно-адренокортикальной системы взрослого потомства при эмоциональном стрессе // Докл. АН СССР. Сер. биол. Т. 271. Вып. 4. С. 1003–1006.
Дыгало Н.Н., Юдин Н.С., Калинина Т.С., Науменко Е.В., 1990. Генетико-физиологические механизмы гормональной модификации стрессовой реактивности // Онтогенетические и генетико-эволюционные аспекты нейроэндокринной регуляции стресса. Новосибирск: Наука. Сиб. отд-ние. С. 136–148.
Евсиков В.И., Мошкин М.П., 1994. Динамика и гомеостаз природных популяций животных // Сиб. экол. журн. No 4. С. 331–346.
Евсиков В.И., Герлинская Л.А., Мошкин М.П., Музыка Г.Г., Назарова Л.Е., Овчинникова М.А., Потапов М.А., Рогов В.Г., 2001. Генетико-физиологические основы популяционного гомеостаза // Водяная полевка / Под ред. Пантелеева П.А. М.: Наука. 527c.
Мошкин М.П., Герлинская Л.А., Евсиков В.И., 1990. Стресс-реактивность и ее адаптивное значение на разных фазах динамики численности млекопитающих (на примере водяной полевки Arvicola terrestris) // Онтогенетические и генетикоэволюционные аспекты нейроэндокринной регуляции стресса. Новосибирск: Наука. Сиб. отд-ние. С. 171–189.
Назарова Г.Г., 2008. Материнское влияние на приспособленность потомков и численность популяции. Автореф. дис… д-ра биол. наук. Новосибирск: Ин-т систематики и экологии животных СО РАН. 39 с.
Назарова Г.Г., Евсиков В.И., 2000. Влияние условий выкармливания на выживаемость потомков, их репродуктивные характеристики и соотношение полов у водяной полевки (Arvicola terrestris) // Зоол. журн. Т. 79. No 1. С. 58–63.
Новиков Е.А., Мошкин М.П., 2009. Роль стресса в модификации онтогенетических программ // Успехи соврем. биологии. Т. 129. No 3. С. 1–12.
Оленев Г.В., 1981. Популяционные механизмы приспособления к экстремальным факторам среды // Журн. общ. биологии. Т. 42. No 4. С. 506–511.
Оленев Г.В., 2002. Альтернативные типы онтогенеза цикломорфных грызунов и их роль в популяционной динамике (экологический анализ) // Экология. No 5. С. 341–350.
Попов С.В., 2011. Механизмы поведения млекопитающих: роль стресса и неопределенности среды. Автореф. дис. … д-ра биол. наук. М.: Ин-т проблем экологии и эволюции им. А.Н. Северцова РАН. 47 с.
Роговин К.А., Мошкин М.П., 2007. Авторегуляция численности в популяциях млекопитающих и стресс (штрихи к давно написанной картине) // Журн.общ. биологии. Т. 68. No 4. С. 244–267.
Ткачев А.В., Аршавская Т.В., Горбачев А.Л., Хляновская И.В., 1987. Морфология нейросекреторной, гипофизарно-адренокортикальной и гипофизарно-тиреоидной системы в раннем онтогенезе копытного лемминга на разных стадиях численности популяции. Магадан: ДВНЦ АН СССР. 242 с.
Шилов И.А., 1982. Популяционный гомеостаз у животных // Бюл. МОИП. Отд. биол. Т. 87. Вып. 4. С. 23–32.
Шилов И.А., 1984. Стресс как экологическое явление // Зоол. журн. Т. 63. Вып. 6. С. 805–812.
Шмальгаузен И.И., 1968. Факторы эволюции. М.: Наука. 451 с.
Allen T.O., Haggett B.N., 1977. Group housing of pregnant mice reduces copulatory receptivity of female progeny // Physiol. Behav. V. 19. P. 61–68.
Auperin B., Geslin M., 2008. Plasma cortisol response to stress in juvenile rainbow trout is influenced by their life history during early development and by egg cortisol content // Gen. Comp. Endocrinol. V. 158. P. 234–239.
Badyaev A.V., 2005. Role of stress in evolution: From individual adaptability to evolutionary adaptation // Variation / Eds Hallgrímsson B., Hall B.K. Burlington, MA, USA: Elsevier Acad. Press. P. 277–302.
Badyaev A.V., 2009. Evolutionary significance of phenotypic accommodation in novel environments: an empirical test of the Baldwin effect // Phil. Trans. R. Soc. B. V. 364. P. 1125–1141.
Badyaev A.V., Uller T., 2009. Parental effects in ecology and evolution: mechanisms, processes and implications // Phil. Trans. R. Soc. B. V. 364. P. 1169–1177.
Banerjee S.B., Arterbery A.S., Fergus D.J., Adkins-Regan E., 2012. Deprivation of maternal care has longlasting consequences for the hypothalamic-pituitary-adrenal axis of zebra finches // Proc. R. Soc. B. V. 279. P. 759–766.
Bergman K., Sarkar P., O’Connor T.G., Modi N., Glover V., 2007. Maternal stress during pregnancy predicts cognitive ability and fearfulness in infancy // J. Amer. Acad. Child Adolesc. Psychiatry. V. 46. P. 1454–1463.
Bernier N.J., Peter R.E., 2001. The hypothalamic pituitary interrenal axis and the control of food intake in teleost fish // Comp. Biochem. Physiol. Part B. V. 129. P. 639–644.
Beydoun H., Saftlas A.F., 2008. Physical and mental health outcomes of prenatal maternal stress in human and animal studies: A review of recent evidence // Paediatric Perinatal Epidemiol. V. 22. P. 438–466.
Bijlsma R., Loeschcke V., 2005. Environmental stress, adaptation and evolution: an overview // J. Evol. Biol. V. 18. Is. 4. P. 744–749.
Blas J., Bortolotti G.R., Tella J.L., Baos R., Marchant T.A., 2007. Stress response during development predicts fitness in a wild, long-lived bird // Proc. Natl. Acad. Sci. USA. V. 104. P. 8880–8884.
Bloss E.B., Janssen W.G., McEwen B.S., Morrison J.H., 2010. Interactive effects of stress and aging on structural plasticity in the prefrontal cortex // J. Neurosci. V. 30. No 19. P. 6726–6731.
Bogoch Y., Biala Y.N., Linial M., Weinstock M., 2007. Anxiety induced by prenatal stress is associated with suppression of hippocampal genes involved in synaptic function // J. Neurochem. V. 101. P. 1018–1030.
Boonstra R., 2005. Equipped for life: the adaptive role of the stress axis in male mammals // J. Mammal. V. 86. P. 236–247.
Boonstra R., Hik D., Singleton G.R., Tinnikov A., 1998. The impact of predator-induced stress on the snowshoe hare cycle // Ecol. Monogr. V. 68. P. 371–394.
Braastad B.O., Osadchuk L.V., Lund G., Bakken M., 1998. Effects of prenatal handling stress on adrenal weight and function and behaviour in novel situations in blue fox cubs (s) // Appl. Anim. Behav. Sci. V. 57. P. 157–169.
Bradshaw A.D., Hardwick K., 1989. Evolution and stress – genotypic and phenotypic components // Biol. J. Linn. Soc. V. 37. P. 137–155.
Branchi I., D’Andrea I., Fiore M., Di Fausto V., Aloe L., Alleva E., 2006. Early social enrichment shapes social behavior and nerve growth factor and brain-derived neurotrophic factor levels in the adult mouse brain // Biol. Psychiatry. V. 60. P. 690–696.
Breuner C.W., Hahn T.P., 2003. Integrating stress physiology, environmental change, and behavior in free-living sparrows // Horm. Behav. V. 43. P. 115–123.
Bruijn A.T., de, Bakel H.J., van, Baar A.L., van, 2009. Sex differences in the relation between prenatal maternal emotional complaints and child outcome // Early Human Dev. V. 85. P. 319–324.
Burton P.J., Waddell B.J., 1999. Dual function of 11B-hydroxysteroid dehydrogenase in placental: modulating placental glucocorticoid passafe and local steroid action // Biol. Reprod. V. 60. P. 234–240.
Catalani A., Alema G.S., Cinque C., Zuena A.R., Casolini P., 2011. Maternal corticosterone effects on hypothalamus-pituitary-adrenal axis regulation and behavior of the offspring in rodents // Neurosci. Biobehav. Rev. V. 25. P. 1502–1617.
Cavigelli S.A., McClintock M.K., 2003. Fear of novelty in infant rats predicts adult corticosterone dynamics and an early death // Proc. Natl. Acad. Sci. USA. V. 100. P. 16131–16136.
Chan E.C., Smith R., Lewin T., Brinsmead M.W., Zhang H.P., Cubis J., Thompson K., Hurt D., 1993. Plasma corticotropin-releasing hormone, beta-endorphin and cortisol inter-relationships during human pregnancy // Acta Endocrinol. (Copen.) V. 128. P. 339–344.
Charil A., Laplante D.P., Vaillancourt C., King S., 2010. Prenatal stress and brain development // Brain Res. Rev. V. 65. No 1. P. 56–79.
Charnov E.L., 1982. The Theory of Sex Allocation. Princeton, New Jersey: Princeton Univ. Press. 356 p.
Chin E.H., Love O.P., Verspoor J.J., Williams T.D., Rowley K., Burness G., 2009. Juveniles exposed to embryonic corticosterone have enhanced flight performance // Proc. R. Soc. Lond. B. V. 276 P. 499–505.
Christian J.J., 1950. The adreno-pituitary system and population cycles in mammals // J. Mammal. V. 31. P. 247–259.
Christian J.J., 1963. Endocrine adaptive mechanisms and the physiologic regulation of population growth // Physiological Mammalogy / Eds Mayer W.V., Gelder R.G. V. 1. N.Y.: Acad. Press. P. 189–359.
Christian J.J., 1968. Endocrine-behavioral negative feedback responses to increased population density // Colloques International Centre National Recherche Scientifique. Paris. V. 173. P. 289–316.
Christian J.J., 1971. Population density and reproductive efficiency // Biol. Reprod. V. 4. P. 248–294.
Christian J.J., 1980. Endocrine factors in population regulation // Biosocial mechanisms of population regulation / Eds Cohen M.N., Malpass R.S., Klein H.G. New Haven: Yale Univ. Press. P. 55–115.
Christian J.J., LeMunyan C.D., 1958. Adverse effects of crowding on lactation and reproduction of mice and two generations of their offspring // Endocrinology (Baltimore). V. 63. P. 517–529.
Coe C.L., Crispen H.R., 2000. Social stress in pregnant squirrel monkeys (Saimiri boliviensis peruviensis) differentially affects placental transfer of maternal antibody to male and female infants // Health Psychol. V. 19. P. 554–559.
Coe C.L., Lubach G.R., Karaszewski J.W., 1999. Prenatal stress and immune recognition of self and non-self in the primate neonate // Biol. Neonate. V. 76. P. 301–310.
Comendant T., Sinervo B., Svensson E.I., Wingfield J., 2003. Social competition, corticosterone and survival in female lizard morphs // J. Evol. Biol. V. 16. P. 948–955.
Coté J., Clobert J., Meylan S., Fitze P.S., 2006. Experimental enhancement of corticosterone levels positively affects subsequent male survival // Horm. Behav. V. 49. P. 320–327.
Coslovsky M., Richner H., 2011. Predation risk affects offspring growth via maternal effects // Funct. Ecol. V. 25. P. 878–888.
Coslovsky M., Groothuis T., Vries B., de, Richner H., 2012. Maternal steroids in egg yolk as a pathway to translate predation risk to offspring: Experiments with great tits // Gen. Compar. Endocrinol. V. 176. I. 2. P. 211–214.
Creel S., 2001. Social dominance and stress hormones // Trends Ecol. Evol. V. 16. No 9. P. 491–497.
Creel S., MarushaCreel N., Monfort S.L., 1996. Social stress and dominance // Nature. V. 379 (6562). P. 212.
Creel S., Dantzer B., Goymann W., Rubenstein D.R., 2013. The ecology of stress: effects of the social environment // Funct. Ecol. V. 27. No 1. P. 66.
Crump C.J., Chevins P.F.D., 1989. Prenatal stress reduces fertility of male offspring in mice without affecting their adult testosterone levels // Horm. Behav. V. 23. P. 333–343.
Cyr N.E., Romero L.M., 2007. Chronic stress in free-living European starlings reduces corticosterone concentrations and reproductive success // Gen. Comp. Endocrinol. V. 151. P. 82–89.
Dahlöf L.G., Hård E., Larsson K., 1977. Influence of maternal stress on offspring sexual behaviour // Anim Behav. V. 25. P. 958–963.
Darnaudéry M., Maccary S., 2008. Epigenetic programming of the stress response in male and female rats by prenatal restraint stress // Brain Res. Rev. V. 57. P. 571–585.
Del Cerro M.C., Perez-Laso C., Ortega E., Martin J.L., Gomez F., Perez-Izquierdo M.A., Segovia S., 2010. Maternal care counteracts behavioral effects of prenatal environmental stress in female rats // Behav. Brain Res. V. 208. P. 593–60.
Denenberg V.H., Karas G.G., 1959. Effects of differential infantile handling upon weight gain and mortality in the rat and mouse // Science. V. 130. P. 629–630.
Desjardins J.K., Fernald R.D., 2010. What do fish make of mirror images? // Biol. Lett. V. 6. P. 744–747.
Dobson H., Smith R.F., 2000. What is stress, and how does it affect reproduction? // Anim. Reprod. Sci. V. 60–61. P. 743–752.
Dores R.M., Garcia Y., 2015. Views on the co-evolution of the melanocortin-2 receptor, MRAPs, and the hypothalamus/pituitary/adrenal-interrenal axis // Mol. Cel. Endocrinol. V. 408. P. 12–22.
Drago F., Di Leo F., Giardina L., 1999. Prenatal stress induces body weight deficit and behavioural alterations in rats: the effect of diazepam // Eur. Neuropsychopharmacol. V. 9. P. 239–245.
Dufty A.M., Clobert J., Møller A.P., 2002. Hormones, developmental рlasticity and adaptation // Trends Ecol. Evol. V. 17. P. 190–196.
Emack J., Kostaki A., Walker C.-D., Matthews S.G., 2008. Chronic maternal stress affects growth, behavior and hypothalamo-pituitaryadrenal function in juvenile offspring // Horm. Behav. V. 54. P. 514–520.
Entringer S., Kumsta R., Hellhammer D.H., Wadhwa P.D., Wust S., 2009. Prenatal exposure to maternal psychosocial stress and HPA axis regulation in young adults // Horm. Behav. V. 55. P. 292–298.
Feist G., Schreck C.B., 2001. Ontogeny of the stress response in chinook salmon, Oncorhynchus tshawytscha // Fish. Physiol. Biochem. V. 25. P. 31–40.
Field T., Diego M., Hernandez-Reif M., Schanberg S., Kuhn C., Yando R., Bendell D., 2003. Pregnancy anxiety and comorbid depression and anger: Effects on the fetus and neonate // Depress. Anxiety. V. 17. P. 140–151.
Fonseca E.S.M., Massoco C.O., Palermo-Neto J., 2002. Effects of prenatal stress on stress-induced changes in behavior and macrophage activity of mice // Physiol. Behav. V. 77. P. 205–215.
Fraipont M., de, Clobert J., John-Alder H., Meylan S., 2000. Increased prenatal maternal corticosterone promotes philopatry of offspring in common lizard Lacerta vivipara // J. Anim. Ecol. V. 69. P. 404–413.
Francis D.D., Meaney M.J., 1999. Maternal care and the development of stress responses // Current Opinion in Neurobiol. V. 9. P. 128–134.
Francis D., Diorio J., Liu D., Meaney M. J., 1999. Nongenomic transmission across generations of maternal behavior and stress responses in the rat // Science. V. 286. P. 1155–1158.
Frank S.A., 1990. Sex allocation theory for birds and mammals // Ann. Rev. Ecol. Syst. V. 21. P. 13–55.
Fride E., Weinstock M., 1988. Prenatal stress increases anxiety related behavior and alters cerebral lateralization of dopamine activity // Life Sci. V. 42. P. 1059–1065.
Frye C.A., Orecki Z.A., 2002. Prenatal stress alters reproductive responses of rats in behavioral estrus and paced mating of hormone-primed rats // Horm. Behav. V. 42. P. 472–483.
Fujioka T., Sakata Y., Yamaguchi K., Shibasaki T., Kato H., Nakamura S., 1999. The effects of prenatal stress on the development of hypothalamic paraventricular neurons in fetal rats // Neuroscience. V. 92. P. 1079–1088.
Funder J.W., 1996. 11β-Hydroxysteroid dehydrogenase: new answers, new questions // Eur. J. Endocrinol. V. 134. P. 267–268.
Gagliano M., McCormick M.I., 2009. Hormonally mediated maternal effects shape offspring survival potential in stressful environments // Oecologia. V. 160. P. 657–665.
Gagliano M., McCormick M.I., Meekan M.G., 2007. Survival against the odds: ontogenetic changes in selective pressure mediate growth-mortality trade-offs in a marine fish // Proc. R. Soc. B. V. 274. P. 1575–1582.
Gibson G., Wagner G.P., 2000. Canalization in evolutionary genetics: A stabilizing theory? // Bioessays. V. 22. P. 372–380.
Giesing E.R., Suski C.D., Warner R.E., Bell A.M., 2011. Female sticklebacks transfer information via eggs: effects of maternal experience with predators on offspring // Proc. R. Soc. Lond. B. V. 278. P. 1753–1759.
Gitau R., Fisk N.M., Teixeira J.M., Cameron A., Glover V., 2001. Fetal hypothalamic–pituitary–adrenal stress responses to invasive procedures are independent of maternal responses // J. Clin. Endocrinol. Metab. V. 86. P. 104–109.
Glover V., 2011. Annual Research Review: Prenatal stress and the origins of psychopathology: an evolutionary perspective // J. Child Psychol. Psychiatry. V. 52. No 4. P. 356–367.
Glover V., O’Connor T.G., O’Donnell K., 2010. Prenatal stress and the programming of the HPA axis // Neurosci. Biobehav. Rev. V. 35. P. 17–22.
Glover V., O’Connor T.G., Heron J., Golding J., 2004. Antenatal maternal anxiety is linked with atypical handedness in the child // Early Human Devel. V. 79. P. 107–118.
Gluckman P.D., Hanson M.A., Spencer H.G., 2005. Predictive adaptive responses and human evolution // Trends Ecol. Evol. V. 20. P. 527–533.
Gluckman P.D., Hanson M.A., Beedle A.S., 2007. Early life events and their consequences for later disease: A life history and evolutionary perspective // Am. J. Human Biol. V. 19. P. 1–19.
Godfray H.C.J., 1995. Evolutionary theory of parent–offspring conflict // Nature. V. 376. P. 1133–1138.
Hadany L., Beker T., Eshel I., Feldman M., 2006. Why is stress so deadly? An evolutionary perspective // Proc.Roy. Soc. B. V. 273. P. 881–885.
Harlow H.F., Harlow M.K., Suomi S.J., 1971. From thought to therapy: lessons from a primate laboratory // Am.Sci. V. 59. P. 538–549.
Harvey P.W., Chevins P.F.D., 1984. Crowding or ACTH treatment of pregnant mice affects adult copulatory behavior of male offspring // Horm. Behav. V. 18. P. 101–110.
Harvey P.W., Chevins P.F.D., 1985. Crowding pregnant mice affects attack and threat behavior of male offspring // Horm. Behav. V. 19. P. 86–97.
Harvey P.W., Chevins P.F.D., 1987. Crowding during pregnancy delays puberty and alters estrous cycles of female offspring in mice // Experientia. V. 43. P. 306–308.
Heindel J.J., Balbus J., Birnbaum L., Brune-Drisse M.N., Grandjean Ph., Gray K., Landrigan Ph.J., Sly P.D., Suk W., Slechta D.C., Thompson C., Hanson M., 2016. Developmental origins of health and disease: Integrating environmental influences // Endocrinology. V.1. P. 17–22.
Hennessy M.B., 1988. Both prevention of physical contact and removal of distal cues mediate cortisol and vocalization responses of guinea pig pups to maternal separation in a novel environment // Physiol. Behav. V. 43. P. 729–733.
Henry C., Kabbaj M., Simon H., Le Moal M., Maccari S., 1994. Prenatal stress increases the hypothalamo-pituitary-adrenal axis response in young and adult rats // J.Neuroendocrinol. V. 6. P. 341–345.
Hoffmann A.A., Parsons P.A., 1997. Extreme environmental change and evolution. Cambridge, UK: Cambridge Univ. Press. 261p.
Holberton R.L., Wingfield J.C., 2003. Modulating the corticosterone stress response: a mechanism for balancing individual risk and reproductive success in arcticbreeding sparrows? // Auk. V. 120. P. 1140–1150.
Holmes T.H., McCormick M.I., 2006. Location influences size-selective predation on newly settled reef fish // Mar. Ecol. Prog. Ser. V. 317. P. 203–209.
Hu F., Crespi E.J., Denver R.J., 2008. Programming neuroendocrine stress axis activity by exposure to glucocorticoids during postembryonic development of the frog Xenopus laevis // Endocrinology. V. 149. P. 5470–5481.
Huizink A.C., Bartels M., Rose R.J., Pulkkinen L., Eriksson C.J., Kaprio J., 2008. Chernobyl exposure as stressor during pregnancy and hormone levels in adolescent offspring // J. Epidemiol. Community Health. V. 62. doi 10.1136/jech.2007.060350
Hunter R.G., 2012. Epigenetic effects of stress and corticosteroids in the brain // Front. Cell. Neurosci. V. 6. No 18. P. 1–8.
Hunter R.G., McEwen B.S., 2013. Stress and anxiety across the lifespan: structural plasticity and epigenetic regulation // Epigenomics. V. 5. No 2. P. 177–194.
Jablonka E., Lamb M.J., 1995. Epigenetic inheritance and evolution: the Lamarckian dimension. Oxford Univ. Press. 347 p.
Kaiser S., Sachser N., 1998. The social environment during pregnancy and lactation affects the female offsprings’ endocrine status and behaviour in guinea pigs // Physiol. Behav. V. 63. P. 361–366.
Kaiser S., Sachser N., 2001. Social stress during pregnancy and lactation affects in guinea pigs the male offsprings’ endocrine status and infantilizes their behaviour // Psychoneuroendocrinology. V. 26. P. 503–19.
Kaiser S., Sachser N., 2005. The effects of prenatal social stress on behaviour: mechanisms and function // Neurosci. Biobehav. Rev. V. 29. P. 283–294.
Kaiser S., Sachser N., 2009. Effects of prenatal social stress on offspring development: pathology or adaptation? // Curr. Dir. Psychol. Sci. V. 18. P. 118–121.
Kaiser S., Kruijver F.P.M., Swaab D.F., Sachser N., 2003a. Early social stress in female guinea pigs induces a masculinization of adult behavior and corresponding changes in brain and neuroendocrine function // Behav. Brain. Res. V. 144. P. 199–210.
Kaiser S., Kruijver F.P.M., Straub R.H., Sachser N., Swaab D.F., 2003b. Early social stress in male guinea pigs changes social behaviour, and autonomic and neuroendocrine functions // J. Neuroendocrinol. V. 15. P. 761–769.
Kitaysky A.S., Piatt J.F., Wingfield J., 2007. Stress hormones link food availability and population processes in seabirds // Mar. Ecol. Prog. Ser. V. 352. P. 245–258.
Kloet E.R., de, Vreugdenhil E., Oitzl M.S., Joels M., 1998. Brain corticosteroid receptor balance in health and disease // Endocr. Rev. V. 19. P. 269–301.
Kloet E.R., de, Sibug R.M., Helmerhorst F.M., Schmidt M., 2005. Stress, genes and the mechanism of programming the brain for later life // Neurosci. Biobehav. Rev. V. 29. P. 271–281.
Krebs C.J., Boutin S., Boonstra R., Sinclair A.R.E., Smith J.N.M., Dale M.R.T., Martin K., Turkington R., 1995. Impact of food and predation on the snowshoe hare cycle // Science. V. 269. P. 1112–1115.
Künzl C., Sachser N., 1997. Verhaltensbiologische untersuchungen zur domestikation des meerschweinchens // Aktuelle Arbeiten zur artgemäßen Tierhaltung 1996. Darmstadt: KTBL. No 376. P. 99–109.
Laplante D.P., Brunet A., Schmitz N., Ciampi A., King S. 2008. Project Ice Storm: Prenatal maternal stress affects cognitive and linguistic functioning in 51/2-yearold children // J. Am. Acad. Child Adolesc. Psychiatry. V. 47. P. 1063–1072.
Lee A.K., McDonald I.R., 1985. Stress and population regulation in small mammals // Oxford Rev. Reprod. Biol. V. 7. P. 261–304.
Levine S., 1957. Infantile experience and resistance to stress // Science. V. 126. P. 405.
Levine S., 1960. Stimulation in infancy // Scientific American. V. 202. P. 880 –886.
Levitt N.S., Lindsay R.S., Holmes M.C., Seckl J.R., 1996. Dexamethasone in the last week of pregnancy attenuates hippocampal glucocorticoid receptor gene expression and elevates blood pressure in the adult offspring in the rat // Neuroendocrinology. V. 64. P. 412–418.
Liu D., Diorio J., Tannenbaumn B., Caldji C., Francis D., Freedman A., Sharma S., Pearson D., Plotsky P.M., Meaney M.J., 1997. Maternal care, hippocampal glucocorticoid receptors, and hypothalamic-pituitary-adrenal responses to stress // Science. V. 277. P. 1659–1662.
Love O.P., Williams T.D., 2008a. The adaptive value of stress-induced phenotypes: effects of maternally derived corticosterone on sex-biased investment, cost of reproduction, and maternal fitness // Am. Nat. V. 172. P. E135–E149.
Love O.P., Williams T.D., 2008b. Plasticity in the adrenocortical response of a free-living vertebrate: the role of pre- and post-natal developmental stress // Horm. Behav. V. 54. P. 496–505.
Love O.P., McGowan P., Sheriff M.J., 2013. Maternal adversity and ecological stressors in natural populations: the role of stress axis programming in individuals, with implications for populations and communities // Funct. Ecol. V. 27. P. 81–92.
Love O.P., Breuner C.W., Vézina F., Williams T.D., 2004. Mediation of a corticosterone-induced reproductive conflict // Horm. Behav. V. 46. P. 59–65.
Love O.P., Chin E.H., Wynne-Edwards K.E., Williams T.D., 2005. Stress hormones: a link between maternal condition and sex-biased reproductive investment // Am. Nat. V. 166. P. 751–766.
Love O.P., Wynne-Edwards K.E., Bond L., Williams T.D., 2008. Determinants of within- and among-clutch variation of yolk corticosterone in the European starling // Horm. Behav. V. 53. P. 104–111.
Love O.P., Gilchrist H.G., Bȗety J., Wynne-Edwards K.E., Berzins L., Williams T.D., 2009. Using life-histories to predict and interpret variability in yolk hormones // Gen. Comp. Endocrinol. V. 163. P. 169–174.
Lucassen P.J., Bosch O.J., Jousma E., Kramer S.A., Andrew R., Seckl J.R., Neumann I.D., 2009. Prenatal stress reduces postnatal neurogenesis in rats selectively bred for high, but not low, anxiety: possible key role of placental 11β-hydroxysteroid dehydrogenase type 2 // Eur. J. Neurosci. V. 29. P. 97–103.
Lupien S.J., McEwen B.S., Gunnar M.R., Heim C., 2009. Effects of stress throughout the lifespan on the brain, beaviour and cognition // Nat. Rev. Neurosci. V. 10. P. 434–445.
Maccari S., Piazza P.V., Kabbaj M., Barbazanges A., Simon H., Le Moal M., 1995. Adoption reverses the long-term impairment in glucocorticoid feedback induced by prenatal stress // J. Neurosci. V. 15. P. 110–116.
Maccari S., Darnaudery M., Morley-Fletcher S., Zuena A.R., Cinque C., Reeth O., Van, 2003. Prenatal stress and long-term consequences: implications of glucocorticoid hormones // Neurosci. Biobehav. Rev. V. 27. P. 119–127.
Magurran A.E., 1990. The inheritance and development of minnow anti-predator behaviour // Anim. Behav. V. 39. P. 834–842.
Marchlewska-Koj A., 1997. Sociogenic stress and rodent reproduction // Neurosci. Biobehav. Rev. V. 21. No 5. P. 699–703.
Marchlewska-Koj A., Kapusta J., Kruczek M., 2003a. Prenatal stress modifies behavior in offspring of bank voles (Clethrionomys glareolus) // Physiol. Behav. V. 79. P. 671–678.
Marchlewska-Koj A., Krucek M., Kapusta J., Pochron E., 2003b. Prenatal stress affects the rate of sexual maturation and attractiveness in bank voles // Physiol. Behav. V. 79. P. 305–310.
Marks I., Nesse R., 1994. Fear and fitness: An evolutionary analysis of anxiety disorders // Ethol. Sociobiol. V. 15. P. 247–261.
Marshall D.J., Uller T., 2007. When is a maternal effect adaptive? // Oikos. V. 116. P. 1957–1963.
Matrisciano F., Tueting P., Dalal I., Kadriu B., Grayson D.R., Davis J.M., Nicoletti F., Guidottia A., 2013. Epigenetic modifications of GABAergic interneurons are associated with the schizophrenia-like phenotype induced by prenatal stress in mice // Neuropharmacology. V. 68. P. 184–194.
Matthews S.G., 1998. Dynamic changes in glucocorticoid and mineralocorticoid receptor mRNA in the developing guinea pig brain // Developmental Brain Res. V. 107. P. 123–132.
Matthews S.G., 2002. Early programming of the hypothalamo-pituitary-adrenal axis // Trends Endocrinol. Metab. V. 13. P. 373–380.
Matthews S.G., Owen D., Kalabis G., Banjanin S., Setiawan E.B., Dunn E.A., Andrews M.H., 2004. Fetal glucocorticoid exposure and hypothalamo-putuitary-adrenal (HPA) function after birth // Endocr. Res. V. 30. P. 827–836.
McCormick M.I., 1998. Behaviorally induced maternal stress in a fish influences progeny quality by a hormonal mechanism // Ecology. V. 79. P. 1873–1883.
McCormick M.I., 1999. Experimental test of the effect of maternal hormones on larval quality of a coral reef fish // Oecologia. V. 118. P. 412–422.
McCormick M.I., 2006. Mothers matter: crowding leads to stressed mothers and smaller offspring in marine fish // Ecology. V. 87. P. 1104–1109.
McEwen B.S., 1999. Stress and hippocampal plasticity // Annu. Rev. Neurosci. V. 22. P. 105–122.
McEwen B.S., 2007. Physiology and Neurobiology of Stress and Adaptation: Central Role of the Brain // Physiol. Rev. V. 87. P. 873–904.
McEwen B.S., 2012. Brain on stress: how the social environment gets under the skin // PNAS. V. 109. No 2. P. 17180–17186.
McEwen B.S., Eiland L., Hunter R.G., Miller M.M., 2012. Stress and anxiety: Structural plasticity and epigenetic regulation as a consequence of stress // Neuropharmacology. V. 62. P. 3–12.
McGhee K.E., Pintor L.M., Suhr E.L., Bell A.M., 2012. Maternal exposure to predation risk decreases offspring antipredator behaviour and survival in threespined stickleback // Funct. Ecol. V. 26. P. 932–940.
McGowan P.O., Szyf M., 2010a. Environmental epigenomics: understanding the effects of parental care on the epigenome // Essays in Biochemestry. V. 48. P. 275–287.
McGowan P.O., Szyf M., 2010b. The epigenetics of social adversity in early life: implications for mental health outcomes // Neurobiol. Disease. V. 39. P. 66–72.
McGowan P.O., Suderman M., Sasaki A., Huang T.C., Hallett M., Meaney M.J., Szyf M., 2011. Broad epigenetic signature of maternal care in the brain of adult rats // PLoS ONE. V. 6. P. e14739.
Meaney M.J., 2001. Maternal care, gene expression, and the transmission of individual differences in stress reactivity across generations // An. Rev. Neurosci. V. 24. P. 1161–1192.
Meaney M., Szyf M., Seckl J.R., 2007. Epigenetic mechanisms of perinatal programming of hypothalamic-pituitary-adrenal function and health // Trends Mol. Med. V. 13. P. 269–277.
Mennes M., Stiers P., Lagae L., Bergh B., Van den, 2006. Long-term cognitive sequelae of antenatal maternal anxiety: Involvement of the orbitofrontal cortex // Neurosci. Biobehav. Rev. V. 30. P. 1078–1086.
Merlot E., Couret D., Otten W., 2008. Prenatal stress, fetal imprinting and immunity // Brain Behav. Immun. V. 22. P. 42–51.
Meylan S., Clobert J., 2005. Is corticosterone-mediated phenotype development adaptive? Maternal corticosterone treatment enhances survival in male lizards // Horm. Behav. V. 48. P. 44–52.
Meylan S., Miles D.B., Clobert J., 2012. Hormonally mediated maternal effects, individual strategy and global change // Phil. Trans. R. Soc. B. V. 367. P. 1647–1664.
Meylan S., Belliure J., Clobert J., Fraipont M., de, 2002. Stress and body condition as prenatal and postnatal determinants of dispersal in the common lizard (Lacerta vivipara) // Horm. Behav. V. 42. P. 319–326.
Mommer B.C., Bell A.M., 2013. A test of maternal programming of offspring stress response to predation risk in threespine sticklebacks // Physiol. Behav. V. 122. P. 222–227.
Monclús R., Tiulim J., Blumstein D.T., 2011. Older mothers follow conservative strategies under predator pressure: the adaptive role of maternal glucocorticoids in yellow-bellied marmots // Horm. Behav. V. 60. P. 660–665.
Morgan C.P., Bale T.L., 2011. Early prenatal stress epigenetically programs dysmasculinization in second-generation offspring via the paternal lineage // J. Neurosci. V. 31. No 33. P. 11748–11755.
Moore I.T., Jessop T.S., 2003. Stress, reproduction, and adrenocortical modulation in amphibians and reptiles // Horm. Behav. V. 43. P. 39–47.
Mueller B.R., Bale T.L., 2008. Sex-specific programming of offspring emotionality after stress early in pregnancy // J. Neurosci. V. 28. No 36. P. 9055–9065.
Muneoka K., Mikuni M., Ogawa T., Kitera K., Kamei K., Takigawa M., Takahashi K., 1997. Prenatal dexamethasone exposure alters brain monoamine metabolism and adrenocortical response in rat offspring // Am. J. Physiol. (Regulatory, Integrative, and Comparative Physiology). V. 273. No 5. Pt 2. P. R1669–R1675.
Murgatroyd C., Patchev A.V., Wu Y., Micale V., Bockmühl Y., Fischer D., Holsboer F., Wotjak C.T., Almeida O.F., Spengler D., 2009. Dynamic DNA methylation programs persistent adverse effects of earlylife stress // Natur. Neurosci. V. 12. P. 1559–1566.
Novikov E., Moshkin M., 1998. Sexual maturation, adrenocortical function and population density of red-backed vole, Clethrionomys rutilus (Pall.) // Mammalia. V. 62. P. 529–540.
Nyman C., Fischer S., Aubin-Horth N., Taborsky B., 2017. Effect of the early social environment on behavioural and genomic responses to a social challenge in a cooperatively breeding vertebrate // Mol. Ecol. V. 26. P. 3186–3203.
Nyman C., Fischer S., Aubin-Horth N., Taborsky B., 2018. Evolutionary conserved neural signature of early life stress affects animal social competence // Proc. R. Soc. B. V. 285. P. 20172344 (1–9).
Obel C., Henriksen T.B., Secher N.J., Eskenazi B., Hedegaard M., 2007. Psychological distress during early gestation and offspring sex ratio // Human Reproduct. V. 22. P. 3009–3012.
Obel C., Henriksen T.B., Dalsgaard S., Hedegaard M., Linnet K.M., Secher N.J., Thomsen P.H., Olsen J., 2003a. Does gestational anxiety result in children’s attention disorders? // Ugeskr. Laeger. V. 165. P. 479.
Obel C., Hedegaard M., Henriksen T.B., Secher N.J., Olsen J., 2003b. Psychological factors in pregnancy and mixed-handedness in the offspring // Devel. Med. Child Neurol. V. 45. P. 557–561.
O’Connor T.G., Heron J., Golding J., Beveridge M., Glover V., 2002a. Maternal antenatal anxiety and children’s behavioural/emotional problems at 4 years. Report from the Avon Longitudinal Study of Parents and Children // Brit. J. Psychiatry. V. 180. P. 502–508.
O’Connor T.G., Heron J., Glover V., 2002b. Antenatal anxiety predicts child behavioral/emotional problems independently of postnatal depression // J. Am. Acad. Child Adolesc. Psychiatry. V. 41. P. 1470–1477.
O’Connor T.G., Ben-Shlomo Y., Heron J., Golding J., Adams D., Glover V., 2005. Prenatal anxiety predicts individual differences in cortisol in pre-adolescent children // Biol. Psychiatry. V. 58. P. 211–217.
Owen D., Andrews M.H., Matthews S.G., 2005. Maternal adversity, glucocorticoids and programming of neuroendocrine function and behaviour // Neurosci. Biobehav. Rev. V. 29. P. 209–226.
Paitz R.T., Mommer B.C., Suhr E., Bell A.M., 2015. Changes in the concentrations of four maternal steroids during embryonic development in the threespined stickleback (Gasterosteus aculeatus) // J. Exp. Zool. V. 323A. P. 422–429.
Parker G.A. Royle N.J., Hartley I.R., 2002. Intrafamilial conflict and parental investment: a synthesis // Philos. Trans. R. Soc. Lond. B. V. 357. P. 295–307.
Peña C.J., Monk C., Champagne F.A., 2012. Epigenetic effects of prenatal stress on 11beta-hydroxysteroid dehydrogenase-2 in the placenta and fetal brain // PloS ONE. V. 7. No 6. P. e39791.
Perkins A.V., Linton E.A., Eben F., Simpson J., Wolfe C.D., Redman C.W., 1995. Corticotrophin-releasing hormone and corticotrophin-releasing hormone binding protein in normal and pre-eclamptic human pregnancies // Br. J. Obstet. Gynaecol. V. 102. P. 118–122.
Peterka M., Peterkova R., Likovsky Z., 2004. Chernobyl: Prenatal loss of four hundred male fetuses in the Czech Republic // Reprod. Toxicol. V. 18. P. 75–79.
Queiroz H., Magurran A.E., 2005. Safety in numbers? Shoaling behaviour of the Amazonian red-bellied piranha // Biol. Lett. V. 1. P. 155–157.
Quenette P.-Y., 1990. Functions of vigilance in mammals: a review // Acta Oecol. V. 11. P. 801–818.
Rice F., Harold G.T., Boivin J., Bree M., van den, Hay D.F., Thapar A., 2010. The links between prenatal stress and offspring development and psychopathology: Disentangling environmental and inherited influences // Psychol. Med. V. 40. P. 335–345.
Roche D.P., McGhee K.E., Bell A.M., 2012. Maternal predator-exposure has lifelong consequences // Biol. Lett. V. 8. P. 932–935.
Rodriguez A., Bohlin G., 2005. Are maternal smoking and stress during pregnancy related to ADHD symptoms in children? // J. Child. Psychol. Psychiatry. V. 46. P. 246–254.
Rodriguez A., Waldenstrom U., 2008. Fetal origins of child non-right-handedness and mental health // J. Child Psychol. Psychiatry. V. 49. P. 967–976.
Rogovin K.A., Randall J.A., Kolosova I.E., Moshkin M.P., 2008. Long-term dynamics of corticosterone in male great gerbils (Rhombomys opimus Licht): Effects of environment and socia demography // Physiol. Beochem. Zool. V. 81. No 5. P. 612–626.
Romero L.M., 2002. Seasonal changes in plasma glucocorticoid concentrations in free-living vertebrates // Gen. Comp. Endocrinol. V. 128. P. 1–24.
Roth T.L., Lubin F.D., Funk A.J., Sweatt J.D., 2009. Lasting epigenetic influence of early-life adversity on the BD-NF gene // Biol. Psychiatry. V. 65. P. 760–769.
Sachser N., 1986. Different forms of social organization at high and low population densities in guinea pigs // Behaviour. V. 97. P. 253–272.
Sachser N., 1993. The ability to arrange with conspecifics depends on social experiences around puberty // Physiol. Behav. V. 53. P. 539–544.
Sachser N., 1998. Of domestic and wild guinea pigs: studies in sociophysiology, domestication, and social evolution // Naturwissenschaften. V. 85. P. 307–317.
Sachser N., Renninger S.-V., 1992. Coping with new social situations: the role of social rearing in guinea pigs // Ethol. Ecol. Evol. V. 4. P. 1–19.
Sachser N., Kaiser S., 1996. Prenatal social stress masculinizes the females’ behaviour in guinea pigs // Physiol. Behav. V. 60. P. 589–594.
Sachser N., Lick C., Stanzel K., 1994. The environment, hormones and aggressive behaviour – a five-year-study in guinea pigs // Psychoneuroendocrinol. V. 19. P. 697–707.
Sachser N., Dürschlag M., Hirzel D., 1998. Social relationships and the management of stress // Psychoneuroendocrinol. V. 23. P. 891–904.
Sachser N., Hennessy M.B., Kaiser S., 2011. Adaptive modulation of behavioural profiles by social stress during early phases of life and adolescence // Neurosci. Biobehav. Rev. V. 35. No 7. P. 1518–1533.
Saino N., Romano M., Ferrari R.P., Martinelli R., Møller A.P., 2005. Stressed mothers lay eggs with high corticosterone levels which produce low quality offspring // J. Exp. Zool. V. 303A. P. 998–1006.
Sapolsky R.M., 1987. Glucocorticoids and hippocampal damage // Trends in Neurosci. V. 10. P. 346–349.
Sapolsky R.M., Romero L.M., Munck A.U., 2000. How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions // Endocrinol. Rev. V. 21. P. 55–89.
Scharloo W., 1991. Canalization: genetic and developmental aspects // Ann. Rev. Ecol. Syst. V. 22. P. 65–93.
Schneider M.L., Moore C.F., Kraemer G.W., Roberts A.D., Dejesus O.T., 2002. The impact of prenatal stress, fetal alcohol exposure, or both on development: perspectives from a primate model // Psychoneuroendocrinology. V. 27. P. 285–298.
Seckl J.R., 2004. Prenatal glucocorticoids and long-term programming // Europ. J. Endocrinol. V. 151. P. U49–U62.
Seckl J.R., Meaney M.J., 2004. Glucocorticoid programming // Annal. New York Acad. Sci. V. 1032. P. 63–84.
Selye H., 1950. Stress. Montreal: Acta Med. Publ. 123 p.
Selye H., 1952. The Story of the Adaptation Syndrome. Montreal: Acta Med. Publ. 225 p.
Selye H., 1981. The stress concept today // Handbook on Stress and Anxiety. Contemporary Knowledge, theory and Treatment / Eds Kutash I.L., Schlesinger L.B. San Francisco: Jossey-Bass. P. 127–143.
Shapiro J.A., 1992. Natural genetic engineering in evolution // Genetica. V. 86. P. 99–111.
Sheriff M.J., Love O.P., 2013. Determining the adaptive potential of maternal stress // Ecol. Letters. V. 16. P. 271–280.
Sheriff M.J., Krebs C.J., Boonstra R., 2009. The sensitive hare: sublethal effects of predator stress on reproduction in snowshoe hares // J. Anim. Ecol. V. 78. P. 1249–1258.
Sheriff M.J., Krebs C.J., Boonstra R., 2010. The ghosts of predators past: population cycles and the role of maternal programming under fluctuating predation risk // Ecology. V. 91. P. 2983–2994.
Sheriff M.J., Krebs C.J., Boonstra R., 2011. From process to pattern: how fluctuating predation risk impacts the stress axis of snowshoe hares during the 10-year cycle // Oecologia. V. 166. P. 593–605.
Shishkina G.N., Dygalo N.N., 2017. The glucocorticoid hypothesis of depression: hystory and prospects // Rus J. Genetics: Appl. Res. V. 7. No 1. P. 128–133.
Shultz M.T., Kitaysky A.S., 2008. Spatial and temporal dynamics of corticosterone and corticosterone binding globulin are driven by environmental heterogeneity // Gen. Comp. Endocrinol. V. 155. P. 717–728.
Silvestre A.M., 2014. How to assess stress in reptiles // J. Exotic Pet Medicine. V. 23. P. 240–243.
Steenbergen P.J., Richardson M.K., Champagne D.L., 2011. The use of the zebrafish model in stress research // Biol. Psychiatry. V. 35. P. 1432–1451.
Stefanski V., Raabe C., Schulte M., 2005. Pregnancy and social stress in female rats: influence on blood leucocytes and corticosterone concentrations // J. Neuroimmunol. V. 162. P. 81–88.
Suchecki D., Palermo-Neto J.P., 1991. Prenatal stress and emotional response of adult offspring // Physiol. Behav. V. 49. P. 423–426.
Suomi S.J., 1991. Early stress and adult emotional reactivity in rhesus monkeys // CIBA Found. Symp. V. 156. P. 171–183.
Szyf M., McGowan P., Meaney M.J., 2008. The social environment and the epigenome // Environ. Mol. Mutagen. V. 49. P. 46–60.
Taborsky B., Tschirren L., Meunier C., Aubin-Horth N., 2013. Stable reprogramming of brain transcription profiles by the early social environment in a cooperatively breeding fish // Proc. R. Soc. B. V. 208. P. 20122605.
Talge N.M., Neal C., Glover V., 2007. Antenatal maternal stress and long-term effects on child neurodevelopment: How and why? // J. Child Psychol. Psychiat. V. 48. P. 245–261.
Thiel D., Jenni-Eiermann S., Braunisch V., Palme R., Jenni L., 2008. Ski tourism affects habitat use and evokes a physiological stress response in capercaillie Tetrao urogallus: a new methodological approach // J. Appl. Ecol. V. 45. P. 845–853.
Trivers R.L., 1974. Parent–offspring conflict // Am. Zool. V. 14. P. 249–264.
Trivers R.L., Willard D.E., 1973. Natural selection of parental ability to vary the sex ratio of offspring // Science. V. 179. P. 90–92.
Van Den Bergh B.R., Marcoen A., 2004. High antenatal maternal anxiety is related mnm ADHD symptoms, externalizing problems, and anxiety in 8- and 9-year-olds // Child Devel. V. 75. P. 1085–1097.
Van Den Bergh B.R., Van Calster B., Smits T., Van Huffel S., Lagae L., 2008. Antenatal maternal anxiety is related to HPA-axis dysregulation and self-reported depressive symptoms in adolescence: A prospective study on the fetal origins of depressed mood // Neuropsychopharmacology. V. 33. P. 536–535.
Van Waes V., Enache M., Dutriez I., Lesage J., Morley-Fletcher S., Vinner E., Lhermitte M., Vieau D., Maccari S., Darnaudery M., 2006. Hypo-response of the hypothalamic-pituitary- adrenocortical axis after an ethanol challenge in prenatally stressed adolescent male rats // Eur. J. Neurosci. V. 24. P. 1193–1200.
Veenema A.H., 2009. Early life stress, the development of aggression and neuroendocrine and neurobiological correlates: what can we learn from animal models? // Front. Neuroendocrinol. V. 30. P. 497–518.
Von Holst D., 1998. The concept of stress and its relevance for animal behavior // Advances in the Study of Behavior / Eds Lehman D.S., Hinde R., Shaw E. L.: Acad. Press. P. 1–131.
Wadhwa P.D., Buss C., Entringer S., Swanson J.M., 2009. Developmental origins of health and disease: Brief history of the approach and current focus on epigenetic mechanisms // Semin. Reprod. Med. V. 27. P. 358–368.
Wadhwa P.D., Dunkel-Schetter C., Chicz-DeMet A., Porto M., Sandman C.A., 1996. Prenatal psychosocial factors and the neuroendocrine axis in human pregnancy // Psychosom. Med. V. 58. P. 432–446.
Ward I.L., 1984. The prenatal stress syndrome: Current status // Psychoneuroendocrinology. V. 9. P. 3–11.
Wasser S.K., Keim J.L., Taper M.L., Lele S.R. 2011. The influences of wolf predation, habitat loss, and human activity on caribou and moose in the Alberta oil sands // Front. Ecol. Environ. V. 9. P. 546–551.
Weaver I.C., Cervoni N., Champagne F.A., D’Alessio A.C., Charma S., Seckl J.R., Dymov S., Szyf M., Meaney M.J., 2004. Epigenetic programming by maternal behavior // Nature Neuroscience. V. 7. P. 847–854.
Weaver I.C., Champagne F.A., Brown S.E., Dymov S., Sharma S., Meaney M.J., Szyf M., 2005. Reversal of maternal programming of stress responses in adult offspring through methyl supplementation: altering epigenetic marking alter in life // J. Neurosci. V. 25. P. 11045–11054.
Weaver I.C., D’Alessio A.C., Brown S.E., Hellstrom I.C., Dymov S., Sharma S., Szyf M., Meaney M.J., 2007. The transcription factor nerve growth factor-inducible protein A mediates epigenetic programming: altering epigenetic marks by immediate-early genes // J. Neurosci. V. 27. P. 1756–1768.
Webster R.C., Young W.C., 1951. Adolescent sterility in the male guinea pig // Fertil. Steril. V. 2. P. 175–81.
Welberg L.A.M., Seckl J.R., 2001. Prenatal stress, glucocorticoids and the programming of the brain // J. Neuroendocrinol. V. 13. P. 113–128.
Welberg L.A.M., Seckl J.R., Holmes M.C., 2001. Prenatal glucocorticoid programming of the brain corticosteroid receptors and corticotrophin-releasing hormone: possible implications for behaviour // Neuroscience. V. 104. P. 71–79.
Weinstock M., 2001. Alterations induced by gestational stress in brain morphology and behaviour of the offspring // Prog. Neurobiol. V. 65. P. 427–451.
Weinstock M., 2005. The potential influence of maternal stress hormones on development and mental health of the offspring // Brain Behav. Immun. V. 19. P. 296–308.
Weinstock M., 2007. Gender differences in the effects of prenatal stress on brain development and behaviour // Neurochem. Res. V. 32. P. 1730–1740.
Weinstock M., 2008. The long-term behavioural consequences of prenatal stress // Neurosci. Biobehav. Rev. V. 32. No 6. P. 1073–1086.
Welcker J., Harding A.M.A., Kitaysky A.S., Speakman J.R., Gabrielsen G.W., 2009. Daily energy expenditure increases in response to low nutritional stress in an Arctic-breeding seabird with no effect on mortality // Funct. Ecol. V. 23. P. 1081–1090.
Wendelaar Bonga S.E., 1997. The stress response in fish // Physiol. Rev. V. 77. P. 591–625.
West S.A., 2009. Sex allocation. Princeton: Princeton Univ Press. 467 p.
Williams J., Taylor E., 2006. The evolution of hyperactivity impulsivity and cognitive diversity // J. R. Soc. Interface. V. 3. P. 399–413.
Wingfield J.C., 2005. The concept of allostasis: coping with a capricious environment // J. Mammal. V. 86. P. 248–254.
Wingfield J.C., 2008. Comparative endocrinology, environment and global change // Gen. Comp. Endocrinol. V. 157. P. 207–216.
Wingfield J.C., Hunt K.E., 2002. Arctic spring: hormone-behavior interactions in a severe environment // Comp. Biochem. Physiol. B. V. 132. P. 275–286.
Wingfield J.C., Ramenofsky M., 1999. Hormones and the behavioral ecology of stress // Stress Physiology in Animals / Ed. Balm P.H.M. Sheffield, England: Sheffield Acad. Press. P. 1–51.
Wingfield J.C., Romero L.M., 2001. Adrenocortical responses to stress and their modulation in free-living vertebrates // Handbook of Physiology: The Endocrine System / Eds McEwen B.S., Goodman H.M. V. IV. Section 7. N.Y.: Oxford Univ. Press. P. 211–234.
Wingfield J.C., Sapolsky R.M., 2003. Reproduction and resistance to stress: when and how // J. Neuroendocrinol. V. 15. P. 711–724.
Wingfield J.C., Maney D.L., Breuner C.W., Jacobs J.D., Lynn S., Ramenofsky M., Richardson R.D., 1998. Ecological bases of hormone-behavior interactions: the “emergency life history stage” // Amer. Zool. V. 38. P. 191–206.
Winslow J.T., Noble P.L., Lyons C.K., Sterk S. M., Insel T.R., 2003. Rearing effects on cerebrospinal fluid oxytocin concentration and social buffering in rhesus monkeys // Neuropsychopharmacology. V. 28. P. 910–918.
Wynne-Edwards V.S., 1962. Animal dispersion in relation to social behaviour. N.Y.: Hafner Publ. Co. 653 pp.
Yehuda R., Engel S.M., Brand S.R., Seckl J., Marcus S.M., Berkowitz G.S., 2005. Transgenerational effects of posttraumatic stress disorder in babies of mothers exposed to the World Trade Center attacks during pregnancy // J. Clin. Endocrinol. Metab. V. 90. P. 4115–4118.
Young A.J., Carlson A.A., Monfort S.L., Russell A.F., Bennett N.C., Clutton-Brock T., 2006. Stress and the suppression of subordinate reproduction in cooperatively breeding meerkats // Proc. Natl. Acad. Sci., USA. V. 103. P. 12005–12010.
Zanette L.Y., White A.F., Allen M.C., Clinchy M., 2011. Perceived predation risk reduces the number of offspring songbirds produce per year // Science. V. 334. P. 1398–1401.
Zielinski W.J., Vandenbergh J.G., Montano M.M., 1991. Effects of social stress and intrauterine position on sexual phenotype in wild-house mice (Mus musculus) // Physiol. Behav. V. 49. P. 117–123.
Zimmer C., Spencer K.A., 2014. Modifications of glucocorticoid receptors mRNA expression in the hypothalamic-pituitary-adrenal axis in response to early-life stress in female Japanese quail // J. Neuroendocrinol. V. 26. P. 853–860.
Журнал общей биологии. 2019. Т.80. №2. С.95-123.