С.Б. Кэрролл
Эта статья основана на курсе лекций памяти Аллана Уилсона, прочитанных в Университете штата Калифорния, Беркли, США, в октябре 2004 г. В классической работе «Эволюция на двух уровнях у людей и шимпанзе», опубликованной 30 лет назад, Мэри-Клер Кинг и Алан Уилсон описали огромное сходство между многими белками человека и шимпанзе (King, Wilson, 1975). Их вывод гласил, что столь малая степень молекулярной дивергенции не может являться причиной анатомических или поведенческих различий между шимпанзе и людьми. Они предположили, что эволюционные изменения анатомии и образа жизни чаще основываются на изменениях в экспрессии генов, а не на изменениях в последовательностях белков.
Эта статья была ключевым событием в трех аспектах. Во-первых, в ней впервые было проведено сравнение большой выборки белков близкородственных видов, и, таким образом, ее можно считать одним из первых вкладов в «сравнительную геномику» (хотя это направление появилось только лишь два десятка лет спустя). Во-вторых, поскольку на основании экстраполяции молекулярных данных авторы делали выводы об эволюции морфологических признаков, эта работа также может считаться пионерским исследованием в области эволюционной биологии развития. В-третьих, акцент на эволюцию человека и его способностей в сравнении с нашим ближайшим ныне живущим родственником стимулировал поиск генетических основ происхождения отличительных признаков человека. Как и большинство работ Уилсона и его коллег, эта статья оказала огромное влияние как на палеоантропологов, так и на молекулярных биологов.
Юбилей статьи М.-К. Кинг и А. Уилсона совпал с моментом, когда сравнительная геномика, эволюционная биология развития и эволюционная генетика располагают беспрецедентными объемами новых данных, а полный геном шимпанзе доступен для изучения.
Таким образом, пришло время для того, чтобы рассмотреть то, что уже сделано, и то, что делается сейчас для выявления взаимосвязи эволюционных процессов, происходящих на двух уровнях – молекулярном и организменном, а также оценить статус гипотезы Кинг и Уилсона о доминирующей роли регуляторных мутаций в эволюции организмов.
Кинг и Уилсон предположили, что эволюция и анатомии, и физиологии, и поведения направлялась изменениями в регуляции экспрессии генов. Прежде всего, надо четко различать эволюцию анатомии и эволюцию физиологии. Изменения таких физических признаков организма, как размер, форма, число или цветовой узор, коренным образом отличаются от изменений, присущих химическим и физиологическим процессам. Многочисленные свидетельства, полученные при изучении эволюции белков, участвующих в восприятии зрительной информации (Yokoyama, 2002), в дыхательных процессах (Jessen et al., 1991), в пищеварительном метаболизме (Zhang et al., 2002) и защите организма-хозяина (Hughes, 2002), говорят о том, что эволюция кодирующих последовательностей играет ключевую роль в формировании некоторых (однако отнюдь не всех) важных физиологических различий между видами. Напротив, вопрос об относительном вкладе эволюции кодирующих и регуляторных последовательностей в эволюцию анатомии все еще остается открытым, чему я и собираюсь уделить основное внимание.
Объем имеющихся в настоящее время прямых доказательств достаточно скромен и включает примеры того вклада, который вносят как кодирующие, так и некодирующие регуляторные последовательности в эволюцию морфологии. Тем не менее я собираюсь представить систему доказательств, основанных как на теоретических рассуждениях, так и на эмпирических исследованиях, объем которых растет очень быстро, того, что эволюция регуляторных последовательностей должна вносить основной вклад в эволюцию формы.
Проверка этого вывода методами сравнительной геномики сопряжена с серьезными трудностями. Зная первичную структуру кодирующей последовательности, мы можем достаточно просто определить ее функцию.
В то же время мы, как правило, не способны расшифровать функциональные свойства некодирующих последовательностей на основе простого изучения их первичной структуры.
Это привело к смещению исследований в сравнительной геномике и эволюционной генетике в сторону анализа и описания легко выявляемых событий, происходящих в кодирующих районах, таких, как дупликации генов и эволюция белковых последовательностей, в то время как некодирующие регуляторные последовательности часто просто игнорируются. Однако некодирующие последовательности составляют не менее двух третей всех последовательностей нашего генома, которые находятся под воздействием стабилизирующего отбора (Waterston et al., 2002). Одним из последствий недостаточного внимания к некодирующим регуляторным последовательностям является возникновение неоправданных надежд на то, что мы можем понять генетические основы морфологического разнообразия на базе простого сравнения геномных последовательностей. Видимое разнообразие любой группы не отражается наиболее легко заметными компонентами генного разнообразия, т. е. разнообразием числа генов или их кодирующих последовательностей.
Для того чтобы понять эволюцию анатомии, мы должны исследовать и осмыслить регуляторные последовательности, а также и те белки, которые участвуют в объединении этих последовательностей в регуляторные контуры, управляющие развитием. Я начну с некоторых исторических и теоретических рассуждений об эволюции регуляторных и кодирующих последовательностей, затем перейду к соображениям, которые возникают при использовании конкретных экспериментальных моделей эволюции анатомии, и, наконец, возвращаясь к исходной точке зрения Кинг и Уилсона, мы обсудим, какое отношение имеет наше понимание морфологической эволюции к современным попыткам понять эволюцию человека.
Развитие представлений о роли регуляторных последовательностей в эволюции
Содержание
- 1 Развитие представлений о роли регуляторных последовательностей в эволюции
- 2 Плейотропия и генная архитектура многоклеточных организмов
- 3 Регуляторные последовательности и эволюция анатомии
- 4 Кодирующие последовательности и эволюция анатомии
- 5 Дупликация генов и эволюция анатомии
- 6 Относительный вклад регуляторных и кодирующих последовательностей в эволюцию анатомии
- 7 Шимпанзе и люди: возвращение к проблеме
- 8 Выводы
- 9 Литература
Полвека назад определение первых последовательностей ряда белков, принадлежащих различным видам, быстро привело к признанию потенциальной значимости макромолекул для понимания эволюционных процессов (Crick, 1958). Значительное сходство гомологичных белков различных видов было отмечено практически сразу (Zuckerkandl, Pauling, 1965) и вызвало вопрос, в какой мере наблюдаемые различия последовательностей являются функционально значимыми (Kimura, 1969). С появлением модели оперонной регуляции генов (Jacob, Monod, 1961) ряд биологов, например Эмиль Цукеркандль, стали рассматривать возможную роль «генов-контролеров» в эволюции, в том числе и в происхождении человека от обезьяны (Zuckerkandl, 1964). Среди теоретических достижений этого периода следует отметить модели регуляции генов у высших организмов, предложенные Роем Бриттеном и Эриком Дэвидсоном, которые абсолютно определенно подчеркивали важность регуляции генов для процесса эволюции (Britten, Davidson, 1969, 1971).
Однако наибольшее влияние в этот период оказала одна публикация – книга Сусуму Оно «Evolution by gene duplication» (Ohno, 1970; В русском переводе эта книга называется «Генетические механизмы прогрессивной эволюции», М.: Мир, 1973. ). С. Оно обратил особое внимание на то, что избыточность генов открывает возможность для появления прежде «запрещенных» мутаций, которые способны наделять белки новыми функциями. Отправной девиз С. Оно –
«естественный отбор всего лишь модифицировал, тогда как избыточность создавала»
– отражает представление о естественном отборе как о процессе в значительной степени стабилизирующем, консервативном. С. Оно утверждал, что «аллельные мутации уже существующих генных локусов не могут вызывать крупных эволюционных изменений». Он предположил, что дупликация регуляторных генов и их контролирующих районов несомненно внесла значительный вклад в эволюцию позвоночных. Однако эта книга была сфокусирована исключительно на эволюции новых белков и не рассматривала созидательный потенциал некодирующих регуляторных последовательностей в создании эволюционной дивергенции (см. Ohno, 1972).
На фоне этих идей и взглядов Алан Уилсон и его коллеги начали серию исследований взаимоотношений между эволюцией хромосом, эволюцией белков и морфологической эволюцией у птиц (Prager, Wilson, 1975), млекопитающих (Wilson et al., 1974a), лягушек (Wilson et al., 1974b) и человекообразных обезьян (King, Wilson, 1975). Несоответствие между эволюцией белков и морфологическими преобразованиями, обнаруженное во всех четырех исследованиях, привело к выводу, что основой морфологической эволюции были эволюционные изменения в «регуляторных системах».
Подобным же образом Франсуа Жакоб предположил, что дивергенция и специализация – это скорее всего результат мутаций, изменяющих «регуляторные контуры», а не химические структуры (Jacob, 1977). Относительный вклад различных механизмов в морфологическую эволюцию зависит как от того, что является возможным с генетической точки зрения, так и от того, что разрешено с точки зрения естественного отбора. Прежде чем перейти к подробному разбору данных, непосредственно относящихся к эволюции анатомии и к вопросу о том, насколько они соответствуют изначальным ожиданиям Кинг и Уилсона, мне кажется полезным рассмотреть в свете нашего сегодняшнего понимания функционирования генов в многоклеточных организмах вопрос о том, какие существуют механизмы и какие факторы определяют их использование в эволюции.
Плейотропия и генная архитектура многоклеточных организмов
Одним из критических факторов, который определяет относительный вклад различных генетических механизмов в изменчивость по морфологическим признакам, является плейотропия (Stern, 2000). Принято считать, что мутации с бóльшими плейотропными эффектами более вредны по их воздействию на приспособленность организмов, являясь соответственно менее общеупотребительным источником изменчивости формы по сравнению с мутациями, которые имеют меньший спектр плейотропии.
За последние 30 лет был выяснен целый ряд ключевых свойств структуры, функционирования и регуляции генов в многоклеточных организмах, которые управляют плейотропностью мутаций и тем самым формируют способность видов порождать морфологическую изменчивость и эволюционировать. Благодаря этим свойствам мутации в различных генах и различных частях генов (т. е. в некодирующих и кодирующих последовательностях) могут разительно отличаться по степени их плейотропии. Например, мутация в кодирующей области транскрипционного фактора, который функционирует во многих тканях, может непосредственно воздействовать на все гены, регулируемые данным белком. Напротив, мутация в одном цис-регуляторном элементе будет влиять на экспрессию гена только в том домене, который регулируется этим элементом.
Джон Герхарт и Марк Киршнер (Gerhart, Kirschner, 1997; Kirschner, Gerhart, 1998) детально обсудили, каким образом определенные свойства генетических регуляторных систем животных влияют на «способность к эволюции» – способность генерировать «совместимую с жизнью» наследуемую изменчивость. Например, избыточность уменьшает ограничение на изменения, позволяя обойти или свести к минимуму потенциально пагубное влияние некоторых мутаций. Компартментализация также способствует изменениям; при разобщении изменений, возникающих в одном процессе, и изменений, возникающих в другом, плейотропия уменьшается.
Целый ряд генетических свойств вносит вклад в избыточность и компартментализацию. Например, дупликация генов создает изначально избыточные паралоги. Соответственно мутации, которые могли бы быть губительными, произойди они в предковом гене, становятся разрешенными и позволяют тем самым осуществить «исследование» нового варианта вне зависимости, находится ли он в кодирующем или регуляторном районе или же в обоих (рис. 1а). Подобным же образом увеличенное число и разнообразие цис-регуляторных элементов создает компартментализацию, делая возможным независимый контроль транскрипции гена в разных частях тела (рис. 1б).
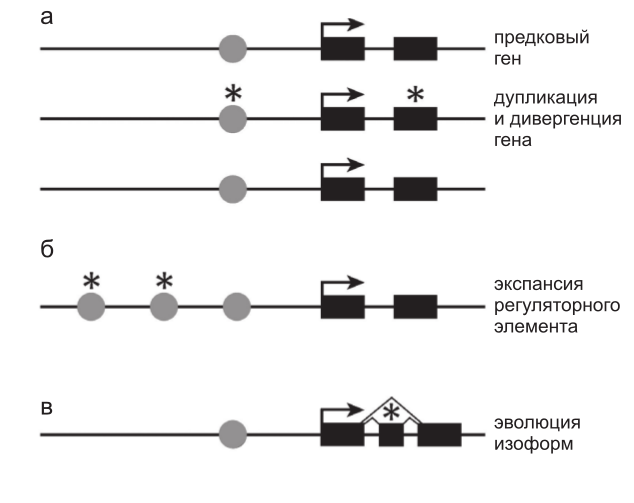
Рис. 1. Различные формы эволюции увеличивают разнообразие функционирования генов и минимизируют плейотропность.
Функция предкового гена с простой структурой, состоящей из цис-регуляторного элемента (кружки) и двух экзонов (прямоугольники), может быть расширена и модифицирована несколькими путями. а – дупликация гена с последующими мутациями (звездочки) в кодирующих или регуляторных последовательностях изначально идентичных паралогов приводит к возникновению генов, которые могут экспрессироваться разными способами, или белков с различными функциями при сохранении исходной функции; б – увеличение числа цис-регуляторных элементов любым из возможных способов (транспозиция, перестройка, дупликация, точечная мутация) может привести к расширению набора тканей, в которых данный ген будет активен при сохранении исходной функции; в – эволюция нового экзона и сайтов сплайсинга создает потенциальную возможность появления альтернативных форм белка. Мутации в альтернативных экзонах (звездочки) могут и
не затрагивать исходную функцию белка.
Использование альтернативных промоторов и сайтов сплайсинга РНК также способствует компартментализации, обеспечивая возможность тканеспецифической продукции альтернативных форм белка и продукции альтернативных форм белка отдельными типами клеток (рис. 1в). Изменчивость может возникать либо в регуляторных последовательностях, которые управляют использованием промоторов или выбором сайтов сплайсинга, либо в кодирующих последовательностях экзонов. Три механизма:
1) дупликация генов;
2) экспансия регуляторных последовательностей и их диверсификация и
3) экспрессия альтернативных изоформ белков – приводят к одному и тому же общему результату, а именно:
они обогащают источники изменчивости и минимизируют плейотропию, связанную с эволюцией кодирующих последовательностей.
Тогда глобальный вопрос о генетической основе морфологической эволюции сводится к вопросу об относительном вкладе, который вносят дупликация генов, изменение регуляторных последовательностей и изменение кодирующих последовательностей за время эволюции. Рассмотрим вначале, что нам известно о роли регуляторных последовательностей, а затем перейдем к обсуждению вклада кодирующих последовательностей и дупликации генов в эволюцию морфологических признаков.
Регуляторные последовательности и эволюция анатомии
За последнее десятилетие сравнительное изучение экспрессии генов различных животных и растений, относящихся ко всем таксономическим уровням, выявило общую связь между приобретением, потерей и модификацией морфологических признаков с одной стороны, и изменением регуляции генов в процессе развития – с другой (Davidson, 2001; Carroll et al., 2005). Изменения экспрессии индивидуального гена могут развиваться через изменения в цис-регуляторных последовательностях или в спектре активности транскрипционных факторов, которые контролируют экспрессию этого гена, или же в результате обоих процессов.
Чтобы пролить свет на механизмы, которые управляют эволюцией специфических признаков и генов, необходимо было исследовать модели, на которых с использованием генетических и молекулярных методов можно идентифицировать и анализировать функциональные различия между популяциями или видами. Такой детальный анализ был возможен для: волосков (Stern, 1998; Sucena, Stern, 2000; Sucena et al., 2003), щетинок (Genissel et al., 2004) и характера пигментации (Kopp et al., 2000) у плодовых мушек; окраски цветков (Durbin et al., 2003), архитектуры (Yoon, Baum, 2004) и типа ветвления у растений (Wang et al., 1999); разнообразия конечностей (Shapiro et al., 2004) и осей тела у позвоночных (Belting et al., 1998). В небольшом числе работ было генетически продемонстрировано, что эволюция определенных локусов повлияла на приобретение (Wang et al., 1999), потерю (Sucena, Stern, 2000; Sucena et al., 2003; Shapiro et al., 2004) или модификацию (Stern, 1998) морфологических признаков.
Результаты этих исследований, приведенные ниже, позволяют категорически исключить изменения кодирующих последовательностей из круга возможных причин этих изменений и, таким образом, указывают на эволюцию регуляторных последовательностей в локусах, кодирующих плейотропные транскрипционные факторы. В нескольких случаях были получены прямые доказательства функциональных изменений цис-регуляторных элементов (Belting et al., 1998; Wittkopp et al., 2002; Gompel et al., 2005).
У плодовых мушек обнаружено множество четко различающихся паттернов черной пигментации на голове, груди, брюшке и крыльях. Эти паттерны регулируются посредством разнообразных весьма консервативных сигнальных путей и транскрипционных факторов, которые контролируют пространственную экспрессию ферментов, стимулирующих или ингибирующих формирование пигмента меланина (Wittkopp et al., 2003). У представителей рода, к которому относится Drosophila melanogaster, структурные гены, такие, как yellow, регулируются совокупностью цис-регуляторных элементов, которые управляют экспрессией гена в различных частях тела, например, в крыле и на брюшке (Wittkopp et al., 2002), а также в щетинках и ротовом аппарате личинок. Такая модульная организация цис-регуляторных элементов предполагает, что экспрессия гена и паттерн пигментации в различных частях тела эволюционируют независимо, посредством изменений индивидуальных цис-регуляторных элементов. Недавние работы показали, что это предположение совершенно справедливо (Wittkopp et al., 2002; Gompel et al., 2005) (рис. 2а).
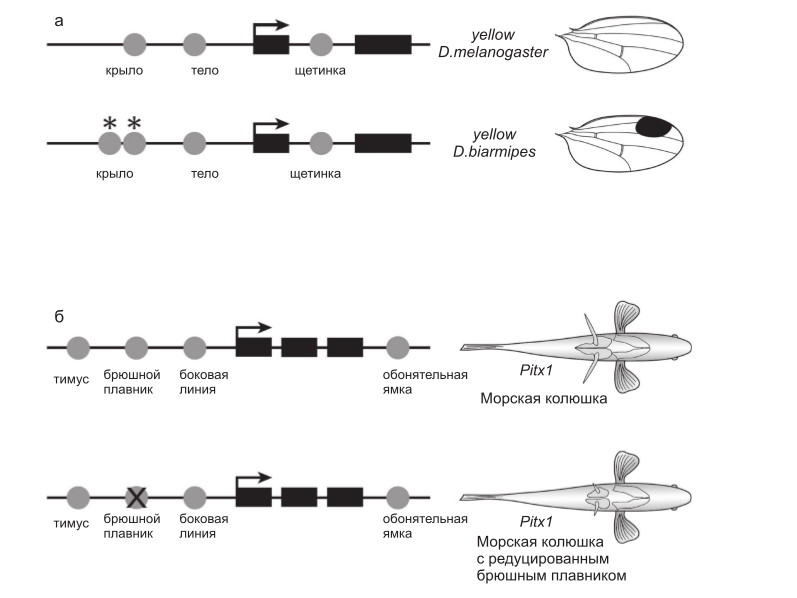
Рис. 2. Модульная архитектура цис-регуляторных районов плейотропных генов обеспечивает независимую эволюцию проявления гена в разных частях тела. а – экспрессия гена пигментации yellow у дрозофилы контролируется несколькими различными цис-регуляторными
элементами (кружки). Отличия в активности отдельных элементов лежат в основе межвидовых различий паттерна пигментации (рисунок составлен по Gompel et al. (2005)); б – считается, что экспрессия гена Pitx1 позвоночных контролируется множественными элементами (кружки). У колюшки с редуцированным брюшными плавниками этот ген не экспрессируется в брюшной области. Предполагается, что это происходит за счет избирательной потери активности одного из регуляторных элементов (перечеркнутый кружок; рисунок составлен по Shapiro et al. (2004)).
Существует целый ряд четко выраженных общих черт эволюции паттерна пигментации у плодовых мушек. Многие или даже все структурные гены, вовлеченные в контроль этого признака, являются плейотропными; они работают в различных частях тела и участвуют в различных физиологических процессах (например, в синтезе нейротрансмиттеров и в контроле поведения). Более того, они регулируются, по крайней мере, частично, широко использующимися, высококонсервативными плейотропными регуляторными белками, некоторые из которых и сами регулируются высококонсервативными и эволюционно стабильными глобальными регуляторами, которые обеспечивают формирование структуры тела (Kopp et al., 2000).
Таким образом, в то время как изменения кодирующих последовательностей структурных и регуляторных белков сдерживаются плейотропией, модульные цис-регуляторные районы обеспечивают возможность появления огромного разнообразия вариантов через изменения регуляторных контуров посредством создания новых комбинаций сайтов для регуляторных белков в цис-регуляторных элементах (Gompel et al., 2005). Это разнообразие создается за счет «попыток подправить» регуляцию с помощью имеющихся компонентов, как это и предугадал Жакоб (Jacob, 1977).
Можно ли считать, что то, что справедливо по отношению к окраске, также справедливо и в случае более сложных признаков? Поскольку характер окраски тела столь важен для адаптации, то генетические системы, которые за него отвечают, могут быть более лабильными по сравнению с системами, которые регулируют более сложные признаки, такие, как организация тела, формирование конечностей и другие, более медленно эволюционирующие признаки. Однако имеющиеся доказательства говорят о том, что возникновение разнообразия других признаков, которые контролируются высокоплейотропными и в значительной мере консервативными белками, также может быть результатом эволюции регуляторных последовательностей.
Например, смещение рострокаудальных границ экспрессии гена Hox приводит к значительным различиям в формировании осей у позвоночных, членистоногих и кольчатых червей (Carroll et al., 2005). В одном случае, а именно для гена Hoxc8 курицы и мыши, было показано, что отличия в функционировании одного цисрегуляторного элемента приводили к различиям границ экспрессии этого гена в нервной трубке и параксиальной мезодерме (Belting et al., 1998).
В то время как различия в осевой морфологии эволюционируют медленно и относительно редко, некоторые характеристики скелета позвоночных, например брюшной плавник рыбы колюшки, изменяются быстро (Bell et al., 1985) и неоднократно (Shapiro et al., 2004). Редукция брюшного плавника, гомолога задней конечности четвероногих, происходит из-за изменений в локусе Pitx1 (Shapiro et al., 2004). Белок Pitx1 является плейотропным транскрипционным фактором, который участвует в развитии многих тканей у рыб, включая и задние конечности мышей. Экспрессия гена Pitx1 в структурах, предшествующих брюшному плавнику, у колюшек с редуцированным брюшным плавником оказалась утеряна при сохранении кодирующей области этого гена в совершенно интактном состоянии, подчеркнем, без каких бы то ни было изменений в кодирующей последовательности по сравнению с популяциями, имеющими полностью сформированные брюшные плавники.
Существует только одно объяснение, которое не противоречит этим наблюдениям, а именно, что регуляторные мутации в цис-элементах, регулирующих экспрессию в структурах, предшествующих брюшному плавнику, избирательно отключили экспрессию Pitx1 именно в этой части развивающегося организма, в то время как экспрессия гена во всех остальных частях тела оказалась незатронутой (рис. 2б).
Ключевым выводом, который следует из примеров эволюции генов Pitx1, yellow и Hoxc8, является то, что регуляторные мутации – это механизм, который обеспечивает изменение одного признака, не затрагивая роль этих плейотропных генов в других процессах. Это, по-видимому, самый важный, самый фундаментальный вывод эволюционной биологии развития. В то время как функциональные мутации в кодирующих районах обычно недопустимы и элиминируются стабилизирующим отбором, в регуляторных элементах разрешены даже те мутации, которые вызывают полную потерю его функции, поскольку компартментализация, создаваемая модульностью цис-регуляторных элементов, лимитирует влияние мутаций на отдельные части тела.
Означает ли это, что кодирующие последовательности не способны вносить какой-либо вклад в эволюцию морфологии? Ни в коей мере. Существует целый ряд ярких примеров функциональных изменений последовательностей белков, которые оказывают влияние на форму, и далее я на них остановлюсь. Необходимо не забывать о следующих ключевых вопросах: как часто и при каких условиях эволюция затрагивает функцию кодирующих последовательностей регуляторных молекул?
Кодирующие последовательности и эволюция анатомии
Общее строение тела членистоногих и четвероногих эволюционировало с использованием довольно стабильного набора генов Hox для каждого типа (Carroll, 1995; Carroll et al., 2005). Постоянство числа генов Hox и сохранение ортологичных[1] последовательностей и функции Hox раньше интерпретировали как свидетельство того, что белки Hox не подверглись значительной функциональной дивергенции. Однако сейчас стало понятно, что у целого ряда Hox-белков членистоногих произошло изменение формы или механизмов развития, включая такие белки, как Hox3, Fushi tarazu, Ultrabithorax (Ubx) и Antennapedia (Shiga et al., 2002). В случае белков Hox3 и Fushi tarazu функция Hox в некоторых видах была утеряна, но были приобретены новые функции. В последовательности белка Fushi tarazu у некоторых видов насекомых был утерян мотив[2], который участвует в реализации функции Hox, однако появился мотив, участвующий в реализации новой для него функции – сегментации (Alonso et al., 2001; Löhr et al., 2001).
Сходным образом белок Hox3 потерял свойственную ему функцию, приобретя новую – функцию, связанную с формированием дорзовентральной оси. Впоследствии он подвергся дупликации, которая привела к образованию двух дивергировавших генов, участвующих в ранних стадиях формирования двух осей тела в одном таксоне мух (Damen, Tautz, 1998; Telford, Thomas, 1998; Stauber et al., 2002).
В белке Ubx функциональные мотивы эволюционировали при сохранении функции Hox. Сравнительные и функциональные исследования показали, что С-конец белка Ubx у ракообразных удлинен и играет роль домена, модулирующего активность (Ronshaugen et al., 2002). У насекомых этот домен заменен коротким глутамин/аланин-богатым мотивом, который сохранялся неизменным на протяжении более чем 300 миллионов лет эволюции насекомых (Galant, Carroll, 2002). На примере Hox-белков членистоногих видно, что некоторые, даже наиболее консервативные, белки способны при определенных обстоятельствах эволюционировать с появлением новых функций, отличных от прежних.
По-видимому, в рассмотренных примерах отбор против изменений в кодирующих последовательностях был ослаблен вследствие избыточности паралогов генов Hox. Однако такие события происходили на протяжении долгой истории этих таксонов достаточно редко по сравнению с огромным многообразием форм тела членистоногих. Необходимо также подчеркнуть, что гены ftz и Hox3 (а также их производные zen и bcd) приобрели абсолютно новые регуляторные элементы, которые осуществляют контроль их экспрессии в новых доменах и структурах.
Более того, механизмы регуляции гена Ubx у членистоногих чрезвычайно разнообразны (Carroll et al., 2005), что в равной степени относится и к насекомым (Warren et al., 1994; Palopoli, Patel, 1998; Mahfooz et al., 2004). Таким образом, несмотря на немногочисленность примеров очевидной эволюции кодирующих последовательностей регуляторных белков, эволюция регуляторных последовательностей, тем не менее, является решающим компонентом функциональной эволюции и дальнейшего формирования разнообразия функций генов.
Существуют ли более общие и быстрые пути эволюции морфологического разнообразия с помощью мутаций в кодирующих последовательностях? Несомненно, существуют. Одним из примеров является рецептор меланокортина-1 (MC1R), который модулирует уровень и тип синтеза меланина в меланоцитах. Мутации в гене MC1R приводят к изменению окраски чешуи, меха и оперения и формируют разнообразие этих признаков у широкого круга видов (Majerus, Mundy, 2003). Поскольку существование альтернативных фенотипов имеет большое экологическое значение, можно предположить, что ген MC1R эволюционировал под действием естественного и полового отбора. В связи с очевидностью примера, который предоставляет эволюция гена MC1R, возникает вопрос, почему же эволюция кодирующих последовательностей преобладает в случае создания разнообразия окрасок у позвоночных, тогда как эволюция регуляции генов играет главную роль в пигментации плодовых мушек и цветков растений?
Возможно, существуют какие-то свойства MC1R, которые дают ему возможность играть такую выдающуюся роль. MC1R является членом семейства, состоящего из пяти родственных рецепторов, и единственным из них, который участвует в регуляции синтеза пигментов (Catania et al., 2004). Таким образом, структурное и регуляторное многообразие этого семейства рецепторов (т. е. эволюция экспрессии MC1R в меланоцитах) привело к возникновению белка, обладающего гораздо большей степенью эволюционной свободы, чем рецепторы с более широким спектром плейотропии. Необходимо отметить, что мутации в кодирующей области гена MC1R влияют на пигментацию на уровне всего тела, а не на появление или изменение пятнышек, полосок или других узоров. Тем не менее вероятно, что эволюция пространственных особенностей пигментации у позвоночных включает эволюцию регуляции экспрессии белков, участвующих в формировании пигментации, или эволюцию регуляторов рецепторной активности (Millar et al., 1995) посредством механизмов, сходных с теми механизмами, которые обеспечивают эволюцию типа окраски насекомых.
По-видимому, широкое участие изменения кодирующей области гена MC1R в видимом разнообразии позвоночных является относительно частным случаем, связанным с вовлеченностью MC1R в пигментацию и его минимальной плейотропностью. Что же касается других белков – белков с более широким плейотропным действием, то можно ожидать, что изменчивость их последовательностей ограничена и, соответственно, ограничен и их вклад в морфологическую изменчивость. Тем не менее недавно показано, что морфологическая изменчивость у пород собак связана с изменениями длины повторяющихся аминокислотных последовательностей в кодирующих областях целого ряда транскрипционных факторов, играющих важную роль в процессе развития (Fondon, Garner, 2004).
Эти повторы кодируются последовательностями микросателлитов и обладают способностью либо быстро удлиняться, либо укорачиваться; и спонтанные или индуцированные мутации этих сайтов влияют на видимые признаки. Исключительная вариабельность повторов по длине и их потенциальное влияние на морфологию увеличивает вероятность того, что эти повторы являются источником изменчивости природных популяций. Однако такая изменчивость может сопровождаться вредными плейотропными эффектами, которыми можно управлять в случае доместикации, но которые в условиях естественного отбора будут ограничивать вклад данных повторов в эволюцию.
Дупликация генов и эволюция анатомии
История Hox-генов и MC1R-гена является отражением того, что одним из условий, необходимых для участия в потенциальной эволюции кодирующих последовательностей, является генерация новых генов посредством дупликации. Широко распространена точка зрения, согласно которой дупликация генов является главной движущей силой эволюции (Ohno, 1970; Taylor, Raes, 2004). Однако эмпирические данные свидетельствуют о том, что на фоне несомненного вклада дупликации генов в эволюцию формы частота дупликаций была явно недостаточна для объяснения постоянной диверсификации таксонов. Этот вывод основан в первую очередь на двух группах наблюдений.
Во-первых, скорость дупликации генов составляет примерно одно событие на ген за 100 млн лет (Lynch, Conery, 2000). Эта цифра говорит о том, что дупликация генов способна вносить вклад в эволюцию в случае более протяженных периодов эволюционного времени (например, на протяжении периодов, превосходящих 50 млн. лет). Однако такая скорость совершенно недостаточна для объяснения популяционной изменчивости (например, изменчивости количественных признаков) или дивергенции близких видов, таких, как 300 тыс. известных видов жуков или 10 тыс. видов птиц.
Во-вторых, относительно невысокая частота дупликации генов отражена в реальной истории семейств ключевых регуляторных генов, участвующих в процессах развития. Например, хотя совершенно ясно, что в процессе ранней эволюции животных произошло увеличение числа генов Hox, а во время ранней эволюции позвоночных произошло увеличение числа кластеров генов Hox, число и количество вариантов этих генов у таких различных таксонов, как членистоногие и четвероногие, оставалось весьма постоянным на протяжении длительного периода (около 500 млн лет).
Другие семейства генов, как, например, семейства сигнальных лигандов Wnt, также характеризуются очень древним разнобразием. Из 12 подсемейств Wnt, известных для позвоночных, 11 были идентифицированы у кишечнополостных (Kusserow et al., 2005). Столь древнее разнообразие намного превосходит тот уровень, который можно было бы ожидать на основании гипотезы о появлении разнообразия непосредственно в результате образования новых генов (Carroll, 1995). Аналогично, несмотря на широко распространенное представление о том, что число генов в геноме человека значительно больше, чем у других видов, это отнюдь не так, подавляющее большинство генов человека имеют синтенные ортологи в геноме мыши (Waterston et al., 2002).
Более того, вклад дупликации генов в эволюцию формы, возможно, определяется в первую очередь дивергенцией регуляции дуплицированных генов, а не новыми функциями, которые приобретаются за счет мутаций в кодирующих областях. Как теоретические рассуждения, так и эмпирические данные говорят о том, что разделение функций прародительского гена может чаще всего происходить посредством регуляторных мутаций или же за счет разделения регуляторных последовательностей во вновь возникшей дупликации (Lynch, Katju, 2004).
Относительный вклад регуляторных и кодирующих последовательностей в эволюцию анатомии
Вышеописанные примеры показывают, что и регуляторные, и кодирующие области генома могут вносить и действительно вносили вклад в эволюцию морфологических признаков. Более субъективным является вопрос о том, можно ли на основании столь небольшой выборки конкретных примеров, рассмотренных в этой статье и имеющихся в литературе, делать утверждения (и отстаивать их) об относительном вкладе изменения регуляторных и кодирующих последовательностей в эволюцию анатомии. Но нам сейчас сделать это легче, чем Кинг и Уилсону 30 лет назад.
Хотя агностическая позиция «поживем – увидим» может показаться более осмотрительной, она ни в коей мере не будет соответствовать смелости ума тех пионеров, которые впервые задались вопросом, поставленным в заголовок этого раздела. Более того, я осмелюсь утверждать, что такая тенденция очевидна и что она должна пройти красной нитью как в уже ведущихся работах, так и в будущих исследованиях.
На основании:
1) эмпирических исследований эволюции признаков и регуляции генов в процессе развития;
2) скорости дупликации генов и частной истории семейств генов, играющих важную роль в процессе развития;
3) того факта, что регуляторные белки являются наиболее медленно эволюционирующими классами белков и
4) теоретических рассуждений, связанных с плейотропностью мутаций,
я берусь утверждать, что у нас есть все основания сделать вывод о том, что эволюция анатомии происходит в первую очередь за счет изменений в регуляторных последовательностях.
Это не удивительно, принимая во внимание, что гипотеза Кинг и Уилсона, а также других исследователей сформировалась уже несколько десятилетий назад. Действительно, большинство приверженцев эволюционной биологии развития не найдут здесь ничего нового. Я, однако, не убежден в том, что все то, что мы узнали об эволюции формы, рассматривается адекватным образом в области сравнительной геномики и популяционной генетики, где потенциальная роль эволюции регуляторных последовательностей либо рассматривается как вторичное явление, либо игнорируется вовсе. Это пренебрежение оказывает фундаментальное влияние на проблему, которая возбудила интерес Кинг и Уилсона, а именно на происхождение различий между шимпанзе и человеком.
Шимпанзе и люди: возвращение к проблеме
Морфологические различия между современным человеком, его предками и человекообразными обезьянами являются результатом эволюционных изменений процесса развития. Выше я уже приводил аргументы в пользу того, что эволюция таких сложных признаков, как размер мозга, черепно-лицевая морфология, области коры головного мозга, отвечающие за речь и язык, форма руки и пальцев, расположение зубов и морфология скелета имеет высокополигенную и в значительной степени регуляторную основу (Carroll, 2003). Теперь, когда нам стали известны последовательности геномов человека, шимпанзе и других млекопитающих, мы можем соотнести изменения в генах с изменениями в признаках. Это огромная и трудная задача. Для решения этой проблемы использовались разные подходы, которые привели к открытию интригующих связей между генами-кандидатами и эволюцией определенных признаков, например, между геном FOXP2 и эволюцией речи (Enard et al., 2002), между псевдогеном миозина MYH16, специфичным для мышц, и эволюционной редукцией жевательного аппарата (Stedman et al., 2004). В данном случае меня не интересует, играли ли эти связи какую-либо роль в эволюции человека, меня тревожит исключительный акцент на эволюции кодирующих последовательностей, сделанный по выбору или по необходимости в большинстве обзоров по этой проблеме (Dorus et al., 2004).
Существует некоторая нестыковка между теми факторами, которые недооцениваются при изучении модельных видов, – способностью или достаточностью регуляторных последовательностей для объяснения эволюции морфологических признаков, с одной стороны, и тем, какие модели эволюции явно или неявно проверяются, когда все внимание сосредоточено исключительно на дивергенции кодирующих последовательностей. Два сюжета о гене FOXP2 иллюстрируют как разительно отличающиеся выводы в зависимости от используемой методологии и принятых допущений.
Ген FOXP2 человека кодирует транскрипционный фактор. Установлено, что мутации в этом локусе связаны с расстройствами речи (Lai et al., 2001). Белок FOXP2 человека отличается от соответствующего белка гориллы и шимпанзе всего лишь двумя аминокислотными остатками, что позволяет предположить, что две замены, произошедшие у человека, могли быть значимыми для эволюции речи. Более того, популяционно-генетический анализ показывает, что локус FOXP2 за последние 200 тыс. лет эволюции человека подвергался значительной «чистке» со стороны отбора (Enard et al., 2002).
Конечно, было бы удобно считать, что эти две замены в белке FOXP2 являются функциональными, но нужно рассмотреть и альтернативную гипотезу о том, что в локусе FOXP2 могли произойти и функциональные регуляторные изменения. Рассматривая альтернативные гипотезы потенциального участия генов FOXP2 или любых других генов в эволюции формы (или компонентов нервной системы), необходимо задаться следующими вопросами: 1) используется ли продукт рассматриваемого гена во многих тканях? 2) дают ли (или могут давать) мутации этого гена плейотропные эффекты? 3) содержит ли соответствующий локус множественные цисрегуляторные элементы?
Если ответ на все эти вопросы положительный, то можно считать, что более вероятная эволюция признака обусловлена эволюцией регуляторных последовательностей, а не изменением кодирующих последовательностей.
FOXP2 является примером именно такого случая. FOXP2 экспрессируется в различных органах – не только в мозге, но также и в легких, и в сердце, и в кишечнике (Lai et al., 2001; Shu et al., 2001). Пациенты с мутациями в гене FOXP2 страдают множественными (плейотропными) нарушениями нервной системы (Vargha-Khadem et al., 2005). И наконец, поскольку FOXP2 экспрессируется в различных органах и различных отделах мозга, этот ген, несомненно, имеет множественные регуляторные элементы. Более того, это гигантский, сложный локус размером около 267 т.п.н. Мы знаем, что средняя оценка дивергенции пар оснований по всему геному между шимпанзе и человеком составляет 1,2 %.
Тогда по одному этому конкретному району шимпанзе должен отличаться от человека на более чем две тысячи нуклеотидов. Поскольку возможности функциональной дивергенции некодирующих последовательностей значительно выше, то и в случае FOXP2 нет никаких причин для предпочтения дивергенции кодирующих последовательностей, а не регуляторных последовательностей.
Открытие FOXP2 и его связи с речью человека дало толчок к рассмотрению возможной роли FOXP2 в эволюции звуковой коммуникации у животных, и именно здесь проверка различных гипотез и использование различной методологии привели к поразительно отличающимся выводам. Способность к обучению пению появилась в процессе эволюции у трех отрядов птиц. Между пением птиц и речью человека существует определенное поведенческое и нейро-физиологическое сходство в том смысле, что обучение пению и речи происходит в критический период развития и в этих процессах участвуют слуховые и моторные центры, а также специальные центры мозга. Стандартный сравнительный анализ кодирующих последовательностей FOXP2 людей и птиц, как обучающихся петь, так и не способных к обучению пению, не выявил, с одной стороны, никаких общих аминокислотных замен у человека и птиц, обучающихся пению, а с другой – никаких закрепленных различий между птицами, обучающимися и не способными к обучению петь. Вывод, сделанный в этой работе, звучит:
«нет никаких доказательств о его [FOXP2] роли в процессе эволюции обучения звуковой коммуникации у животных» (Webb, Zhang, 2005).
Однако данные, полученные при исследовании мРНК FOXP2 и экспрессии соответствующего белка в развивающемся и взрослом мозге целого ряда птиц, обучающихся и не способных к обучению пению, представляли разительный контраст, поскольку в зоне X, т. е. в центре, необходимом для обучения пению, было обнаружено удивительное увеличение экспрессии FOXP2, отсутствующее у птиц, которые не способны обучаться пению (Haesler et al., 2004) (рис. 3a–в). Это увеличение наблюдалось у зебровых амадин в течение периода развития, когда происходит обучение пению.
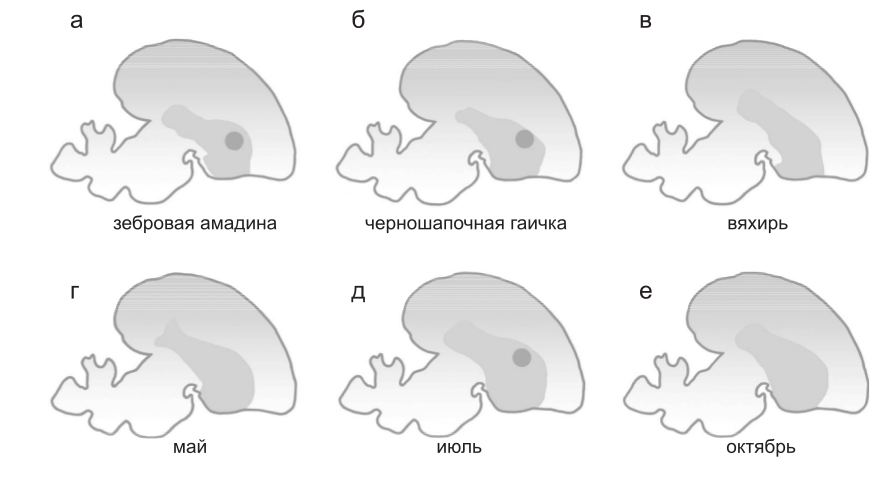
Рис. 3. Эволюция регуляции FOXP2 и происхождение способности к обучение пению у птиц. а–в – паттерны экспрессии FOXP2, показанные на срезах мозга. Темно-серым цветом отмечен стриатум. Экспрессия FOXP2 увеличена в центре, отвечающем за вокализацию, который носит название зоны Х (черная точка) у видов, способных обучаться пению, таких, как зебровая амадина (а) и черноголовая (б), но не у вида, который не способен обучаться пению, – вяхиря (в). г–е – у канареек экспрессия FOXP2 в зоне Х меняется в зависимости от времени года: повышенная экспрессия наблюдается в периоды, когда песня птицы становится пластичной (темная точка). (Рисунок составлен по Haesler et al., 2004).
Более того, у взрослых канареек наблюдались сезонные изменения экспрессии FOXP2 в зоне Х, которые были связаны со стабильностью песен этих птиц (рис. 3г–е). Таким образом, с развитием и эволюцией обучения пению у птиц коррелируют впечатляющие изменения в регуляции FOXP2, а вовсе не в последовательности соответствующего белка. Эти изменения могли возникнуть посредством эволюции цис-регуляторных последовательностей самого FOXP2 или же кодирующих последовательностей транскрипционных факторов, которые контролируют экспрессию FOXP2.
Контраст между отрицательными выводами, сделанными на основании анализа кодирующих последовательностей, и замечательная корреляция, которая обнаруживается при сравнительном изучении регуляции гена in vivo, ярко показывает, какие несоответствия и потенциальные ошибки могут возникнуть при анализе роли кодирующих районов в эволюции морфологических и поведенческих признаков.
Неадекватность этого подхода проявляется не только при анализе эволюции форм. Применение стандартного популяционно-генетического анализа к изучению последовательностей белков человека (Clark et al., 2003; Dorus et al., 2004) позволило выявить несколько примеров позитивной селекции по цис-регуляторным
последовательностям генов физиологических признаков (Rockman et al., 2003, 2004; Hahn et al., 2004). Один из них – абсолютно четкий случай эритроид-специфичной утраты экспрессии рецептора хемокинов – антигена Duffy – в популяциях, устойчивых к заболеванию малярией, которую вызывает Plasmodium vivax (Livingstone, 1984). В данном случае потеря экспрессии связана с регуляторной мутацией, которая влияет на эритроидную цис-регуляторную последовательность и не оказывает какого-либо воздействия на экспрессию данного рецептора во всех остальных тканях (Tournamille et al., 1995).
Таким образом, всё это делает необходимым критически оценивать любые утверждения или заявления по поводу генетических изменений, которые «превращают нас в человека», с точки зрения возможностей и ограничений применяемой методологии и границ проверяемых гипотез. Вполне понятно, что некоторые биологи поддаются искушению воспользоваться тем, что просто само идет в руки, а именно изменениями в кодирующих последовательностях, но, тем не менее, разгадка головоломки регуляторных последовательностей еще ждет нас впереди.
Выводы
Гипотеза об эволюции регуляторных последовательностей, сформулированная Кинг и Уилсоном 30 лет назад, полностью основывалась на негативных результатах, т. е. на том, что дивергенция кодирующих последовательностей явно недостаточна для объяснения имеющихся существенных различий между организмами.
Потребовалось несколько десятилетий, чтобы получить доказательства того, что регуляторные последовательности столь часто являются основой для эволюции форм, чтобы убедиться в том, что гипотеза об эволюции регуляторных последовательностей должна стоять на первом месте при рассмотрении эволюции анатомии (включая компоненты нервной системы). Особая сложность анализа эволюции регуляторных последовательностей заключается в том, что с помощью простого сравнения невозможно с первого взгляда отличить бессмысленные изменения от функциональных. Однако, что касается моделей, не включающих человека, для которых применим широкий набор экспериментальных методов, в этом случае у нас есть повод для реальной надежды на то, что в ближайшее время вклад регуляторных последовательностей в эволюцию будет становиться все более и более ясным. Для того же, чтобы приблизиться к пониманию происхождения признаков, отличающих человека, необходимо уделить значительно большее внимание сравнительному изучению экспрессии, регуляции и развития генов у человекообразных обезьян и других приматов. Именно это и предсказали Кинг и Уилсон 30 лет назад (King, Wilson, 1975), но только сейчас у нас появилась реальная возможность воплотить это в жизнь.
Благодарности
Я признателен М.-К. Кинг за комментарии по поводу статьи, которую она написала в 1975 г. совместно с А. Уилсоном, Л. Олдсу, за подготовку иллюстраций, а также А. Рокасу, Б. Уилльямсу, К. Хиттингеру, Б. Хершу, П. Кэрроллу и С. Пэддоку за полезные замечания. Работа в моей лаборатории проводилась при поддержке Медицинского института Говарда Хьюза (Howard Hughes Medical Institute).
Литература
Alonso C., Maxton-Kuechenmeister J., Akam M. Evolution of Ftz protein function in insects // Curr. Biol. 2001. V. 11. P. 1473–1478.
Bell M.A., Baumgartner J.V., Olson E.C. Patterns of temporal change in single morphological characters of a Miocene stickleback fsh // Paleobiology. 1985. V. 11. P. 258–271.
Belting H.G., Shashikant C.S., Ruddle F.H. Modifcation of expression and cis-regulation of Hoxc8 in the evolution of diverged axial morphology // Proc. Natl Acad. Sci. USA. 1998. V. 95. P. 2355–2360.
Britten R.J., Davidson E.H. Gene regulation for higher cells: A theory // Science. 1969. V. 165.
P. 349–357.
Britten R.J., Davidson E.H. Repetitive and non-repetititive RNA sequences and a speculation on the origins of evolutionary novelty // Quart. Rev. Biol. 1971. V. 46. P. 111–138.
Carroll S.B. Homeotic genes and the evolution of arthropods and chordates // Nature. 1995. V. 376. P. 479–485.
Carroll S.B. Genetics and the making of Homo sapiens // Nature. 2003. V. 422. P. 849–857.
Carroll S.B., Grenier J.K., Weatherbee S.D. // From DNA to Diversity: Molecular Genetics and the Evolution of Animal Design. 2nd ed. Malden: Blackwell Scientifc, 2005. 258 p.
Catania A., Gatti S., Lipton J.M. Targeting melanocortin receptors as a novel strategy to control infammation // Pharmacol. Rev. 2004. V. 56. P. 1–29.
Clark A.G., Glanoski S., Nielsen R. et al. Inferring nonneutral evolution from human-chimp-mouse orthologous gene trios // Science. 2003. V. 302. P. 1876–1877.
Crick F.H.C. On protein synthesis // Symp. Soc. Exp. Biol. 1958. V. 12. P. 138–163.
Damen W.G.M., Tautz D.A Hox class 3 orthologue from the spider Cupiennius salei is expressed in a Hox-gene-like fashion // Dev. Genes Evol. 1998. V. 208. P. 586–590.
Davidson E.H. Genomic Regulatory Systems: Development and Evolution. San Diego: Academic Press, 2001. 261 p.
Dorus S., Vallender E.J., Evans P.D. et al. Accelerated evolution of nervous system genes in the origin of Homo sapiens // Cell. 2004. V. 119. P. 1027–1040.
Durbin M.L., Lundy K.E., Morrell P.L. et al. Genes that determine fower color: The role of regulatory changes in the evolution of phenotypic adaptations // Mol. Phylogenet. Evol. 2003. V. 29. P. 507–518.
Enard W., Przeworski M., Fisher S.E. et al. Molecular evolution of FOXP2, a gene involved in speech and language // Nature. 2002. V. 428. P. 869–872.
Fondon J.W., Garner H.R. Molecular origins of rapid and continuous morphological evolution // Proc. Natl Acad. Sci. USA. 2004. V. 101. P. 18058–18063.
Galant R., Carroll S.B. Evolution of a novel transcriptional repression domain in the Ultrabithorax Hox protein in insects // Nature. 2002. V. 415. P. 848–849.
Genissel A., Pastinen T., Dowell A. et al. No evidence for an association between common nonsynonymous polymorphisms in delta and bristle number variation in natural and laboratory populations of Drosophila melanogaster // Genetics. 2004. V. 166. P. 291–306.
Gerhart J., Kirschner M. Cells, Embryos, and Evolution. Malden: Blackwell Science, 1997. 642 p.
Gompel N., Prud’homme B., Wittkopp P.J. et al. Chance caught on the wing: Cis-regulatory evolution and the origin of pigment patterns in Drosophila // Nature. 2005. V. 433. P. 481–487.
Haesler S., Wada K., Nshdejan A. et al. FoxP2 expression in avian vocal learners and non-learners // J. Neurosci. 2004. V. 24. P. 3164–3175.
Hahn M.W., Rockman M.V., Soranzo N. et al. Population genetic and phylogenetic evidence for positive selection on regulatory mutations at the factor VII locus in humans // Genetics. 2004. V. 167. P. 867–877.
Hughes A.L. Natural selection and the diversifcation of vertebrate immune effectors // Immunol. Rev. 2002. V. 190. P. 161–168.
Jacob F. Evolution and tinkering // Science. 1977. V. 196. P. 1161–1166.
Jacob F., Monod J. Genetic regulatory mechanisms in the synthesis of protein // J. Mol. Biol. 1961. V. 8. P. 318–356.
Jessen T.H., Weber R.E., Fermi G. et al. Adaptation of bird hemoglobins to high altitudes: Demonstration of molecular mechanism by protein engineering // Proc. Natl Acad. Sci. USA. 1991. V. 88. P. 6519–6522.
Kimura M. The rate of molecular evolution considered from the standpoint of population genetics // Proc. Natl Acad. Sci. USA. 1969. V. 63. P. 1182–1188.
King M.C., Wilson A.C. Evolution at two levels in humans and chimpanzees // Science. 1975. V. 188. P. 107–116.
Kirschner M., Gerhart J. Evolvability // Proc. Natl Acad. Sci. USA. 1998. V. 95. P. 8420–8427.
Kopp A., Duncan I., Godt D., Carroll S.B. Genetic control and evolution of sexually dimorphic characters in Drosophila // Nature. 2000. V. 408. P. 533–559.
Kusserow A., Pang K., Sturm C. et al. Unexpected complexity of the Wnt gene family in a sea anemone // Nature. 2005. V. 433. P. 156–160.
Lai C.S.L., Fisher S.E., Hurst J.A. et al. A forkhead-domain gene is mutated in a severe speech and language disorder // Nature. 2001. V. 413. P. 519–523.
Livingstone F.B. The Duffy blood groups, vivax malaria, and malaria selection in human populations: A review // Hum. Biol. 1984. V. 56. P. 413–425.
Lockton S., Gaut B.S. Plant conserved non-coding sequences and paralogue evolution // Trends Genet. 2005. V. 21. P. 60–65.
Löhr U., Yussa M., Pick L. Drosophila fushi tarazu: A gene on the border of homeotic function // Curr. Biol. 2001. V. 11. P. 1403–1412.
Lynch M., Conery J.S. The evolutionary fate and consequences of duplicate genes // Science. 2000. V. 290. P. 1151–1155.
Lynch M., Katju V. The altered evolutionary trajectories of gene duplicates // Trends Genet. 2004. V. 20. P. 544–549.
Mahfooz N.S., Li H., Popadic A. Differential expression patterns of the hox gene are associated with differential growth of insect hind legs // Proc. Natl Acad. Sci. USA. 2004. V. 101. P. 4877–4882.
Majerus M.E.N., Mundy N.I. Mammalian melanism: Natural selection in black and white // Trends Genet. 2003. V. 19. P. 585–588.
Millar S.F., Miller M.W., Stevens M.E., Barsh G.S. Expression and transgeneic studies of the mouse agouti gene provide insight into the mechanisms by which mammalian coat color patterns are generated // Development. 1995. V. 121. P. 3223–3232.
Ohno S. An argument for the genetic simplicity of man and other animals // J. Hum. Evol. 1972. V. 1. P. 651–662.
Ohno S. Evolution by Gene Duplication. N.Y.: Springer-Verlag, 1970. 160 p. (Русский перевод: Оно С. Генетические механизмы прогрессивной эволюции. М.: Мир, 1973. 227 с.
Palopoli M.F., Patel N.H. Evolution of the interaction between Hox genes and a downstream target // Curr. Biol. 1998. V. 8. P. 587–590.
Prager E.M., Wilson A.C. Slow evolutionary loss of the potential for intersspecifc hybridization in birds // Proc. Natl Acad. Sci. USA. 1975. V. 72. P. 200–204.
Rockman M.V., Hahn M.W., Soranzo N. et al. Positive selection on a human-specifc transcription factor binding site regulating IL4 expression // Curr. Biol. 2003. V. 13. P. 2118–2123.
Rockman M.V., Hahn M.W., Soranzo N. et al. Positive selection on MMP3 regulation has shaped heart disease risk // Curr. Biol. 2004. V. 14. P. 1531–1539.
Ronshaugen M., McGinnis N., McGinnis W. Hox protein mutation and macroevolution of the insect body plan // Nature. 2002. V. 415. P. 914–917.
Shapiro M.D., Marks M.E., Peichel C.L. et al. Genetic and developmental basis of evolutionary pelvic reduction in threespine sticklebacks // Nature. 2004. V. 428. P. 717–723.
Shiga Y., Yasumoto R., Yamagata H., Hayashi S. Evolving role of Antennapedia protein in arthropod limb patterning // Development. 2002. V. 129. P. 3555–3561.
Shu W., Yang H., Zhang L. et al. Characterization of a new subfamily of winged-helix/forkedhead (Fox) genes that are expressed in the lung and act as transcriptional repressors // J. Biol. Chem. 2001. V. 276. P. 27488–27497.
Stauber M., Prell A., Schmidt-Ott U. A single Hox3 gene with composite bicoid and zerknüllt expression characteristics in non-Cyclorrhaphan fies // Proc. Natl Acad. Sci. USA. 2002. V. 99. P. 274–279.
Stedman H.H., Kozyak B.W., Nelson A. et al. Myosin gene mutation correlates with anatomical changes in the human lineage // Nature. 2004. V. 428. P. 415–418.
Stern D.L. A role of Ultrabithorax in morphological differences between Drosophila species // Nature. 1998. V. 396. P. 463–466.
Stern D.L. Perspective: Evolutionary developmental biology and the problem of variation // Evolution. 2000. V. 54. P. 1079–1091.
Sucena E., Delon I., Jones I. et al. Regulatory evolution of shavenbaby/ovo underlies multiple cases of morphological parallelism // Nature. 2003. V. 424. P. 935–938.
Sucena E., Stern D.L. Divergence of larval morphology between Drosophila sechelia and its sibling species caused by cis-regulatory evolution of ovo/shavenbaby // Proc. Natl Acad. Sci. USA. 2000. V. 97. P. 4530–4534.
Taylor J.S., Raes J. Duplication and divergence: The evolution of new genes and old ideas // Annu. Rev. Genet. 2004. V. 38. P. 615–643.
Telford M.J., Thomas R. Of mites and zen: Expression studies in a chelicerate arthropod confrm zen is a divergent Hox gene // Dev. Genes Evol. 1998. V. 208. P. 591–594.
Tournamille C., Colin Y., Cartron J.P., Le Van Kim C. Disruption of a GATA motif in the Duffy gene promoter abolishes erythroid gene expression in Duffy-negative individuals // Nat. Genet. 1995. V. 10. P. 224–228.
Vargha-Khadem F., Gadian D.G., Copp A., Mishkin M. FOXP2 and the neuroanatomy of speech and language // Nat. Rev. Neurosci. 2005. V. 6. P. 131–138.
Wang R.L., Stec A., Hey J. et al. The limits of selection during maize domestication // Nature. 1999. V. 398. P. 236–239.
Warren R., Nagy L., Selegue J. et al. Evolution of homeotic gene regulation and function in fies and butterfies // Nature. 1994. 372. P. 458–461.
Waterston R.H., Lindblad-Toh K., Birney E. et al. Initial sequencing and comparative analysis of the mouse genome // Nature. 2002. V. 420. P. 560–562.
Webb D.M., Zhang J. FoxP2 in song-learning birds and vocal-learning mammals // J. Hered. 2005. V. 96. P. 1–5.
Wilson A.C., Maxson L.R., Sarich V.M. Two types of molecular evolution. Evidence from studies of interspecifc hybridization // Proc. Natl Acad. Sci. USA. 1974a. V. 71. P. 2843–2847.
Wilson A.C., Sarich V.M., Maxson L.R. The importance of gene rearrangement in evolution // Proc. Natl Acad. Sci. USA. 1974b. V. 71. P. 3028–3030.
Wittkopp P.J., Kopp A., Carroll S.B. Evolution in black and white: Genetic control of pigment patterns in Drosophila // Trends Genet. 2003. V. 19. P. 495–504.
Wittkopp P.J., Vaccaro K., Carroll S.B. Evolution of yellow gene regulation and pigmentation in Drosophila // Curr. Biol. 2002. V. 12. P. 1547–1556.
Yokoyama S. Molecular evolution of color vision in vertebrates // Gene. 2002. V. 300. P. 69–78.
Yoon H.S., Baum D.A. Transgenic study of parallelism in plant morphological evolution // Proc. Natl Acad. Sci. USA. 2004. 101. V. 6524–6529.
Zhang J., Zhang Y.P., Rosenberg H.F. Adaptive evolution of a duplicated pancreatic ribonuclease gene in a leaf-eating monkey // Nat. Genet. 2002. V. 30. P. 411–415.
Zuckerkandl E. Controller-gene diseases: The operon model as applied to beta-thalassemia, familial fetal hemoglobinemia and the normal switch from the production of fetal hemoglobin to that of adult hemoglobin // J. Mol. Biol. 1964. V. 8. P. 128–147.
Zuckerkandl E., Pauling L. Evolutionary divergence and convergence in proteins // Evolving Genes and Proteins / Eds V. Bryson, H.J. Vogel. N.Y.: Academic Press, 1965. P. 97–166.
Оригинал в PloS Biology, 12 July 2005.
Источник Вестник ВОГиС. 2007. №2.
[1] Про гомологию в сравнительной геномике, ортологи и паралоги см. популярно тут и строго тут.
[2] Мотив в ДНК – определённая в разной степени вырожденная (неточная) последовательность ДНК, с которой, как правило, связываются функционально значимые белки и другие молекулярные комплексы. Обнаруживается обычно в целой группе фрагментов ДНК, имеющих сходную функциональную значимость (например, в энхансерах, регулирующих реакцию на определённый стероидный гормон). В силу вырожденности большинства мотивов, при которой гомологичные участки этих фрагментов не совпадают полностью, мотивы часто характеризуются матрицей, в которой указана, какова вероятность встретить тот или иной нуклеотид в той или иной позиции.