Александр Чубенко.
С появлением антибиотиков человечеству стало казаться, что многие болезни отступили навсегда. Но увы, вскоре оказалось, что бактерии быстро вырабатывают устойчивость к этим препаратам. Ученые разрабатывали все новые антибиотики, но и к ним микроорганизмы рано или поздно приспосабливались. Кто же победит в этой неумолимой гонке вооружений — люди или микробы?
Доклад генерального директора ВОЗ Маргарет Чен «Устойчивость к противомикробным препаратам в Европейском союзе и в мире» на прошедшей в 2012 году в Копенгагене конференции «Борьба с устойчивостью к противомикробным препаратам — время действовать» произвел эффект разорвавшейся бомбы. Хотя скорее это было похоже на вскрытие давно назревшего нарыва: то, что микробы быстро приобретают устойчивость к антибиотикам, Александр Флеминг заметил еще до того, как во время Второй мировой войны началось промышленное производство пенициллина.
Несколько десятков лет после появления пенициллина фармакологи продолжали разрабатывать новые антибиотики, врачи — успешно их применять, и к концу 1970-х казалось, что инфекционным болезням скоро настанет конец… но конец настал оптимистичным прогнозам. Тем более что активная разработка более эффективных модификаций известных классов антибиотиков по многим, в том числе финансовым причинам в последние десятилетия постепенно сокращалась. А последний новый класс — фторхинолоны — появился в 1980 году. Да и их с тех пор только модифицировали и совершенствовали.
Рост числа устойчивых штаммов специалисты обсуждали и 20, и 30 лет назад, но в подавляющем большинстве случаев в узкоспециализированных научных журналах. В 2001 году, когда стало окончательно ясно, что фармпромышленность проигрывает в гонке с патогенами, ВОЗ обнародовала Глобальную стратегию по сдерживанию кризиса резистентности к противомикробным препаратам. Но призыв срочно приступить к решению проблемы совпал с терактами 11 сентября и письмами со спорами сибирской язвы, переключившими внимание общественности и правительств на борьбу с терроризмом.
Только после конференции в Копенгагене в СМИ наконец началась паника. И хотя в популярных статьях ужасы грядущего конца света часто сильно преувеличивают, шумиха вокруг наступления постантибиотиковой эры пошла на пользу разработчикам антимикробных средств: о проблеме задумались не только специалисты, но и грантодатели, и фармкомпании.
Самые опасные
В опубликованном осенью 2013 года Центрами по контролю и профилактике заболеваний США (CDC) докладе «Угроза устойчивости к антибиотикам в Соединенных Штатах» (Antibiotic resistance threats in the United States, 2013) перечислено около 15 наиболее опасных и распространенных штаммов и групп «супермикробов», распределенных по трем степеням угрозы здоровью населения.
К первой группе — микробов, «представляющих наибольшую угрозу и требующих немедленного реагирования» — авторы отнесли возбудителей псевдомембранозного колита и гонореи, а также энтеробактерии.
Clostridium difficile, возбудитель псевдомембранозного колита. После курса лечения антибиотиками от любой другой болезни и вызванного им подавления нормальной микрофлоры эта инфекция может проявиться во всем диапазоне кишечных расстройств, от относительно безопасной диареи до перфорации кишки. В 2000 году появился особенно заразный штамм клостридии, устойчивый к фторхинолоновым антибиотикам. Ежегодные потери от этой инфекции в США, по последним данным, около 250 000 заболевших, миллиард долларов на их лечение и 14 000 умерших.
Энтеробактерии (бактерии рода Klebsiella и патогенные штаммы кишечной палочки), устойчивые к наиболее сильнодействующим антибиотикам — карбапенемам. В год — 9000 случаев, 600 смертей.
Neisseria gonorrhoeae. Реальное число заболевших гонореей в США специалисты оценивают примерно в 820 000 в год — почти в три раза больше, чем по официальной статистике. Распространенность самолечения и нелеченных из-за бессимптомного течения болезни случаев ускорили рост числа штаммов гонококка, устойчивых к одному или нескольким антибиотикам (сейчас их — уже 30%). В 2009 году в Японии был выявлен устойчивый к последней надежде венерологов — цефалоспоринам — штамм H041. Пока он не получил широкого распространения, но если так пойдет и дальше…
А оно, несомненно, так и пойдет, и без принятия срочных мер самые пессимистичные прогнозы о «мире без антибиотиков» могут стать реальностью.
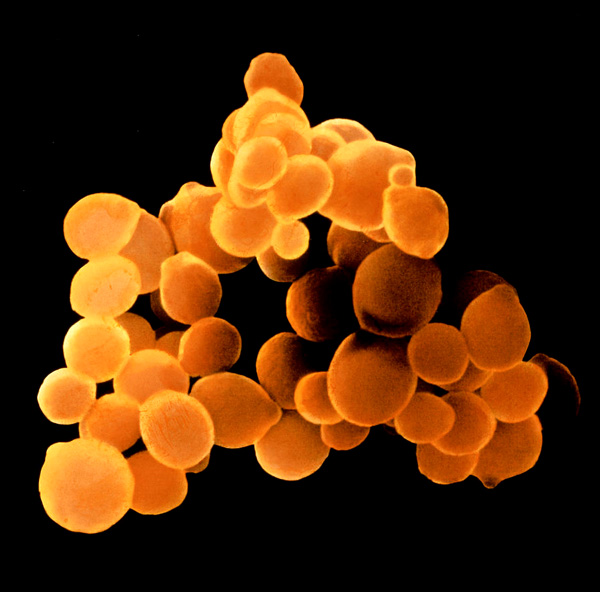
Ко второй группе супербактерий, «представляющих серьезную угрозу», авторы доклада отнесли устойчивые к флуконазолу дрожжеподобные грибы рода Candida (в том числе вид Candida albicans, известный многим если не по латинскому названию, то по русскому слову «молочница») и 11 бактерий, в том числе самый известный из супермикробов — метициллинрезистентный золотистый стафилококк (MRSA). На его долю приходится от 30 до 60% госпитальных инфекций, причем не в Африке, а в развитых странах, где его эволюцию подстегивали особенно активно. Около трети заболевших умирают даже при самом адекватном лечении.
Красивое имя Staphylococcus aureus получил в честь формы колоний при выращивании в культуре («staphyle» — «гроздь винограда», кокки — бактерии округлой формы), а золотистый он потому, что, в отличие от большинства бактерий, от природы бесцветных, окрашен в желто-оранжевый цвет за счет пигмента стафилоксантина.
Этот условно-патогенный микроорганизм присутствует на коже и слизистых оболочках 20% населения и, пока с хозяином все в порядке, никак не проявляет своей зловредной сущности. Но при нарушенном иммунитете, попадании в царапины и раны или в кровяное русло (например, с инъекцией или капельницей) он может вызвать множество болезней, начиная с кожных инфекций и заканчивая смертельно опасными заболеваниями, от некротического воспаления легких до менингита. А пищевые продукты, в которых размножился S. aureus, могут привести к пищевому отравлению вплоть до инфекционно-токсического шока.
До появления антибиотиков смертность от стафилококковых инфекций в крови или внутренних органах доходила до 90%. После появления пенициллина она начала снижаться, но к 1950 году устойчивость к пенициллину выработали 40% больничных штаммов, а к 1960-му — уже 80%. Некоторое время врачам удалось продержаться за счет новых модификаций антибиотиков того же класса бета-лактамов, но буквально через несколько месяцев и на них коварный микроб начинал вырабатывать гены лактамаз с соответствующей резьбой. Название «метициллинрезистентный» ввели, когда стало ясно, что госпитальные штаммы S. aureus начали сопротивляться самому новому на тот момент (1959) представителю бета-лактамов — метициллину. На это микробам потребовалось всего два года: о первом случае выявления MRSA сообщили в 1961-м. Но примерно до 1990 года заболевания, вызванные MRSA, оставались редкостью, и метициллин продолжали применять, тем более что действующие на MRSA антибиотики других классов (например, гликопептиды или аминогликозиды) имеют слишком много побочных эффектов и/или неудобны в применении (предусматривают только внутривенное введение и постоянный контроль состава крови во избежание передозировки). Некоторое время последней линией обороны был ванкомицин — антибиотик из группы гликопептидов, но уже появились штаммы, устойчивые и к нему.
Примерно так же развивается лекарственная устойчивость и у микробов, отнесенных CDC к третьему классу опасности (два штамма стрептококков, устойчивых к эритромицину и клиндамицину, и штамм золотистого стафилококка, устойчивый к ванкомицину). К сожалению, нет никаких оснований надеяться на то, что следующий список супермикробов станет короче.
Не только бактерии
Устойчивость к противомикробным препаратам развивается и у патогенных грибков, паразитов и вирусов. Но главная проблема грозящего медицине кризиса — это антибиотикорезистентные штаммы бактерий, и прежде всего — госпитальные инфекции.
Кто виноват?
Врачи продолжают прописывать антибиотики без необходимости — и по инерции, и для страховки от обвинений в бездействии. Там, где антибиотики можно купить без рецепта, пациенты часто принимают их по собственному разумению. В результате около 70% антибиотиков применяется без достаточных оснований (в том числе при вирусных инфекциях, хотя единственный эффект от такого «лечения» — появление штаммов бактерий, устойчивых к данному антибиотику). И даже если антибиотики назначены по показаниям, больше половины пациентов забывают вовремя их принимать и/или заканчивают лечение раньше положенного срока (Флеминг и об этом говорил как о самом эффективном способе выработать у бактерий резистентность к пенициллину).
Огромный вклад в искусственный отбор устойчивых штаммов внесли животноводы: в Северной Америке и в Европе (до введения ЕЭС запрета на применение антибиотиков для профилактики болезней и в качестве стимуляторов роста) половина производства противомикробных препаратов работала на сельское хозяйство. Результат — не только нечувствительные к антибиотикам инфекции, которые могут передаваться людям (например, сальмонеллез), но и множество других видов микробов (в том числе патогенных для человека), которые встретились с устойчивыми штаммами в природе и получили от них гены устойчивости.
Самый опасный путь появления устойчивых штаммов — госпитальные инфекции (к ним относятся две из трех перечисленных выше «сверх-супер-бактерий»). Микробы, выжившие в помещениях, насквозь пропитанных лекарствами и переполненных людьми с ослабленным иммунитетом, особенно быстро теряют чувствительность ко всем видам антибиотиков и, несмотря на ужесточение мер антисептики, легко находят себе новые жертвы. Большинство супермикробов относятся именно к госпитальным штаммам.
Что будет, если…
Резистентные бактерии обнаруживаются (вначале — как единичные случаи) максимум через несколько лет после появления нового антибиотика, а иногда — еще на стадии его клинических исследований. Из разработанных с 1940-х годов примерно 150 антибиотиков больше половины практически потеряли эффективность и используются на авось — как препараты первой линии. Если болезнь прорвет ее оборону, врачи отступают на вторую линию, потом — на третью. А новые и (пока!) эффективные лекарства намного дороже старых, иногда — в сто и более раз.
Опубликованный в декабре 2014 года отчет «Антибиотикорезистентность: необходимы срочные меры против кризиса ради здоровья и благосостояния населения» (Antimicrobial Resistance: Tackling a crisis for the health and wealth of nations), подготовленный по поручению премьер-министра Великобритании Дэвида Кэмерона исследовательской группой из института RAND Europe и аудиторской компанией KPMG, страшнее любого голливудского ужастика.
В 2050 году из-за лекарственной устойчивости в мире (в основном в бедных странах Африки и Азии) ежегодно будут умирать не 700 000 человек, как сейчас, а 10 млн. Прямой ущерб для мировой экономики составит в сумме $100−120 трлн, а с учетом косвенных последствий вроде роста детской и материнской смертности, опасности сепсиса после любых хирургических вмешательств и вообще разрушения современной системы здравоохранения — в два раза больше. Перед медициной встает реальная перспектива отката на полтора века назад, когда почти половина детей не доживала до года, туберкулез был смертным приговором и т. д.
Правда, сами авторы отмечают, что рассчитали пессимистический сценарий — что будет, если не принимать меры по исправлению сложившейся ситуации. А меры уже принимаются.
Устойчивость по наследству
Гены устойчивости можно получить с помощью вертикального переноса — по наследству от родительской клетки, горизонтального — в результате конъюгации — своеобразного полового процесса, при котором бактерии соединяются участками клеточных стенок и обмениваются генами, или с помощью бактериофагов, которые, разбегаясь из убитой бактерии, могут вместе со своими генами прихватить участок микробной ДНК, передать ее следующей зараженной бактерии и погибнуть под действием бактериального иммунитета.
Что делать?
То же, что и раньше — разрабатывать новые противомикробные средства, тем более что в развитых странах под общим руководством ВОЗ уже приняты программы борьбы с лекарственной устойчивостью, и не голословные, а подкрепленные миллиардными субсидиями. Да и без этого работа не прекращалась, в том числе благодаря новым методам разработки лекарств, позволяющим довести новый препарат от идеи до аптеки не за 10−15 лет и миллиард долларов, а намного быстрее и дешевле. И антибиотики исследователи не собираются списывать в архив: в 2014 году FDA одобрило четыре новых антибиотика, и еще несколько десятков, в том числе новых классов, находятся на разных стадиях исследований.
В 2006 году из одного из видов стрептомицетов — актинобактерий, благодаря которым разработано множество антибиотиков, от стрептомицина (второго после пенициллина) до новейших (например, неомицина и хлорамфеникола), выделили две перспективные молекулы ацилдепсипептидов (ADEP). В отличие от известных антибиотиков, они работают по принципиально новому механизму — присоединяются к белку ClpP, в норме разрушающему неправильно собранные или поврежденные белки, и заставляет его крушить все белки подряд, выводя бактерию из строя. Природный антибиотик в опытах на мышах и крысах подавлял туберкулез, некоторые виды пневмонии, стафилококковые и другие инфекции, но для кандидата в лекарственные препараты — недостаточно эффективно. В январе 2014 года были опубликованы результаты испытаний химически модифицированных ADEP (пока — только «в пробирке», но весьма обнадеживающие). Молекулы ADEP4 в семь раз прочнее связываются с ClpP и уничтожают устойчивые к другим антибиотикам бактерии в концентрациях от 30 до 1200 меньших, чем природный антибиотик.
Антибиотик без резистентности?
Еще одна международная группа исследователей под руководством профессора Кима Льюиса из Северо-Западного университета в Бостоне (он, кстати, участвовал и в разработке ADEP) намного дальше продвинулась в поиске новых антибиотиков из некультивируемых микроорганизмов. Микробов они буквально по одному заключали в гелевые микрокапсулы, позволяющие получать питательные вещества из родной земли, а потом постепенно переводили размножившиеся бактерии на искусственное питание. Перебрав десятки тысяч образцов, они выделили 25 наиболее перспективных кандидатов, самым интересным из которых оказался теиксобактин (teixobactin), подавляющий синтез предшественников пептидогликана и тейхоевой кислоты, необходимых для формирования клеточной стенки микробов. Такой механизм действия убивает сразу двух зайцев: оба этих вещества присутствуют практически у всех бактерий — значит, теиксобактин, если он пройдет клинические исследования, может оказаться антибиотиком если не универсальным, то как минимум широкого спектра действия. Во-вторых, выработать резистентность к нему будет весьма затруднительно: к препаратам, действующим на белки, можно приспособиться за счет мутаций, а мишени теиксобактина — вещества небелковые. Действительно, испытания «в пробирке» показали, что ни золотистый стафилококк, ни туберкулезная микобактерия под действием теиксобактина не смогли образовать ни одной устойчивой к нему бактерии. В январе 2015 года в журнале Nature была опубликована статья об успешных испытаниях теиксобактина на мышах. Грызуны, зараженные смертельными дозами MRSA или пневмонийного стрептококка, выжили без побочных эффектов. Клинические исследования на добровольцах разработчики планируют начать уже в этом году.
Не только антибиотики
Есть еще и бактериофаги (вирусы бактерий) — и обычные, которые не получили широкого распространения из-за своей высокой специфичности (определение патогена с точностью до штамма и подбор и размножение вируса требует на несколько недель больше времени, чем поход в аптеку за антибиотиком), и в виде заранее составленных «коктейлей», уничтожающих большинство штаммов определенного вида патогенов, и «троянские». Например, несущие генную конструкцию, кодирующую белок Cas9, который разрезает гены, обеспечивающие устойчивость к антибиотикам (при этом все потомки зараженной бактерии навсегда теряют антибиотикорезистентность). Или заряженные геном антибиотика, не способного проникнуть через клеточную стенку бактерий: фаги протыкают ее, вводят в бактерию ДНК, и патоген начинает сам синтезировать ядовитое для себя вещество.
Можно надеяться и на антимикробные пептиды — цепочки из нескольких десятков аминокислот, способные встраиваться в трехмерную структуру микробных белков и нарушать их функцию. К сожалению, по ряду причин их внедрение в практику в ближайшие годы не ожидается, но работы в этом направлении ведутся довольно интенсивно.
Так что нам бы день продержаться да ночь простоять — а там, глядишь, очередной конец света и отменят…
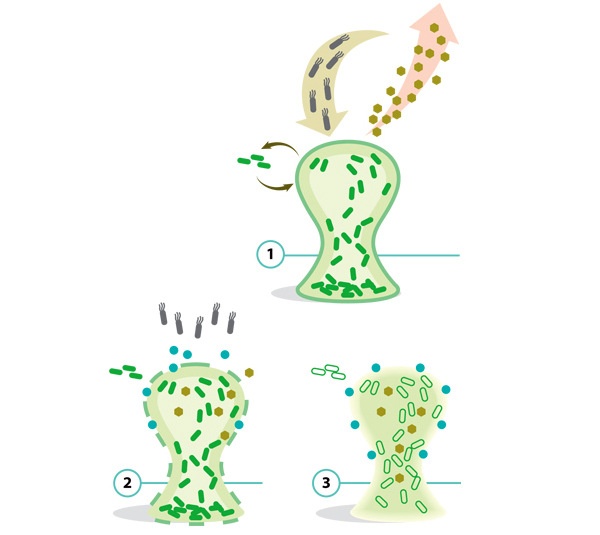
Найти и уничтожить
Изящное решение разработано группой Мэтью Чана в Наньянском технологическом университете (Сингапур). Обычную кишечную палочку ученые превратили в оружие против Pseudomonas aeruginosa — синегнойной палочки, частой причины больничных инфекций. В геном «бактерии-бомбы» ввели четырехступенчатую конструкцию. Первая синтезирует белки-индикаторы, которые связываются с сигнальными молекулами, обеспечивающими «чувство кворума» синегнойной палочке и другим микробам-коллективистам, образующим скопления-биопленки, связанные молекулами ДНК. Получившийся комплекс запускает сразу три реакции: синтез антимикробного пептида микроцина S, фермента ДНКазы-I, разрушающей биопленку (оба соединения выделяются в окружающую среду через клеточную мембрану), и комплекса белков, обеспечивающих движение кишечных палочек в направлении большей концентрации «молекул кворума». В результате разрушаются и патогены, образующие биопленку, и отделяющиеся от нее микробы. Как и методика выращивания «в клетке» некультивируемых бактерий, этот метод является принципиально новой платформой, позволяющей создавать новые противомикробные средства.
Антибактериальная бомба
1. Кишечная палочка выделяет белки-индикаторы, которые демаскируют синегнойную палочку.
2. «Бомба» выделяет вещества, убивающие синегнойную палочку и разрушающие биопленку: происходит «взрыв».
3. Осколки бомбы (кишечная палочка) двигаются в направлении противника, и цикл начинается снова
«Популярная механика» №3, 2015