С.А.Лашин, В.В.Суслов, Ю.Г.Матушкин
В работе проводится обзор теорий биологической эволюции, сформулированных в течение послед них двухсот лет, с учетом достижений современной генетики. Теория генных сетей как одно из основных направлений системной биологии является звеном, объединяющим различные эволюционные теории.
Понятие “эволюция” широко используется в современных точных и естественных науках как синоним развития или изменения (от лат. Evolutio – развертывание). Обычно так называют процесс необратимого изменения системы, детерминированный ее исходным состоянием (эволюция Вселенной, звезд, планет, химических элементов, климата, ландшафта и т.д.). Внешние события могут менять траекторию такого развития, но такие изменения относительно предсказуемы, если известны исходное состояние системы и характеристики модифицирующих воздействий. Совсем другое значение имеет термин “эволюция” применительно к биологии.
В биологии четко отличают процесс реализации уже существующей генетической программы (онтогенез) от процесса возникновения и становления новой генетической программы (филогенез). Под эволюцией подразумевают именно филогенез. Существующие теории эволюции удобно разделить на дарвиновские и недарвиновские по роли случайности в эволюции[1] [1]. В дарвиновских теориях эволюция является детерминистически невоспроизводимым процессом, поскольку в ходе нее одна закономерная траектория развития признака (онтогенез) спонтанно и случайно заменяется на другую – одну из множества возможных. Одной из причин детерминистической невоспроизводимости служит вероятностный характер изменчивости, прежде всего мутаций и рекомбинаций. Даже полностью контролируя условия среды при развитии клонов, мы сможем лишь менять частоту мутирования, но ничего не сможем сказать ни о том, какая именно особь будет нести мутацию, ни о характере этой мутации [3].
Отсюда также следует превалирование монофилии над полифилией и дивергенции над конвергенцией в дарвиновских теориях эволюции. При этом отбор является важным, но не единственным фактором, обеспечивающим фиксацию нового варианта онтогенеза в популяции (в малых популяциях возможна фиксация и без отбора [4]). В частности, именно общим вектором отбора объясняются конвергенции [5].
Недарвиновские теории считают эволюцию детерминистически воспроизводимой: изменение онтогенеза функционально (динамически) опосредуется либо средой через взаимодействие “организм–среда” (механоламаркизм) [6], либо предопределено свойствами самого организма (психоламаркизм) или структурой его частей (номогенез) [7]. При этом отбор вовсе не исключается, но его роль минимизируется постоянным многократным воспроизведением одних и тех же уклонений в развитии, так что выбирать по сути либо не из кого[2] [6], либо отсекаются лишь крайние, нежизнеспособные варианты [7]. Детерминистическая воспроизводимость фактически стирает грань между онтогенезом и филогенезом [6, 8] и подразумевает превалирование полифилии и конвергенции, которым отбор (если его роль признается) только мешает.
В современных дарвиновских теориях эволюционный процесс подразделяется на стадии микро- и макроэволюции [4]. Микроэволюция – это протекание эволюционных процессов внутри популяций, рас и других объединений особей, вплоть до вида. Такие объединения особей имеют общий перемешиваемый генофонд, т.е. некоторую степень внутренней связанности и внешней изоляции. В больших популяциях отбор является главным фактором микроэволюции. Кроме того, процесс микроэволюции определяется также случайными факторами, например генетическим дрейфом в малых популяциях и молекулярным драйвом, унифицирующим повторяющиеся последовательности в геномах за счет неравного кроссинговера при мейозе, генной конверсии и транспозиции [4]. В ходе микроэволюции мутантные аллели могут фиксироваться, элиминироваться (гибнуть), либо, когда отбор идет в пользу гетерозигот, возникает сбалансированный полиморфизм [9, 10].
Макроэволюция – напротив, протекание эволюционных процессов в репродуктивно изолированных таксонах (начиная от вида и выше). Макроэволюционные процессы на много порядков более длительны, чем микроэволюционные. При этом на сегодняшний день не существует однозначного мнения по поводу сущности и механизмов макроэволюции [11]. Так, в синтетической теории эволюции – СТЭ [5, 12] признается, что макроэволюция полностью сводится к микроэволюционным процессам в популяциях и никаких особых механизмов не имеет [13, 14]. Границей между микро- и макроэволюцией является установление внутреннего репродуктивного барьера между популяциями, после чего они считаются разными видами [5, 15]. Современные исследования подтвердили, что образование такого барьера действительно может быть вызвано даже постепенным накоплением точковых мутаций. Так, у 25 видов моллюска морское ушко (Haliotis) выявлена адаптивная эволюция белка спермлизина, отвечающего за видоспецифичность акросомной реакции [16]. У человекообразных приматов адаптивно эволюционируют белки протамины [17].
Наиболее полно вышеописанному сценарию соответствует градуальная эволюция, предложенная еще Ч. Дарвином. Градуализм предполагает постепенную дивергенцию между родственными таксонами путем равномерного накопления небольших изменений (“природа не делает скачков”). Таким образом, происходит дивергенция сперва на подвиды, затем на виды, а уже потом со временем разделившиеся виды накопят различия до уровня родов, семейств и т.д.
По сути градуализм – это единственный сценарий эволюции, получивший количественно разработанную математическую теорию в рамках СТЭ [5, 12], сформированной в результате синтеза классического дарвинизма, хромосомной теории наследования Т. Моргана и генетики популяций. Место дарвиновской неопределенной изменчивости в СТЭ заняла мутационная и рекомбинационная изменчивость, не зависящая ни от среды обитания организмов, ни от отбора. Отбор лишь фиксирует изменчивость, но сам ее не создает. В классической теории Моргана–Меллера отбор направлен на незначительную фракцию новых генов, возникающих в результате мутаций (самопроизвольных или индуцированных внешними воздействиями) [9]. Однако, поскольку обычно мутанты обладают пониженной жизнеспособностью, большинство из таких мутаций должно быть рецессивно или полурецессивно – будь мутации доминантными, приводящими к изменению первого же поколения потомков, они тут же элиминировались бы отбором [12]. В балансовой теории С.С. Четверикова отбор направлен именно на гетерозиготы и комбинации генов.
Влияние генов на признаки организма нельзя назвать взаимно-однозначным – с одной стороны, каждый признак кодируется многими генами (полимерия признаков), с другой – каждый ген влияет на экспрессию нескольких признаков (плейотропия). Плейотропия и полимерия отражают взаимодействие генов, благодаря которому внешнее проявление каждого гена зависит от его генетического окружения [9, 18, 19]. Взаимодействие генов обусловливает скрытую изменчивость, не выявляемую в фенотипе [20]. Поэтому в балансовой теории важнейшим фактором эволюции является рекомбинация – процесс перемешивания генотипов, преимущественно в ходе полового размножения, приводящий к разрушению старых и появлению новых сочетаний генов, выводимых таким образом из состояния скрытой изменчивости и попадающих под действие естественного отбора [12, 21]. Кроме того, рекомбинация позволяет эффективно элиминировать неадаптивные мутации “генетического груза”. Рекомбинация позволяет восстановить случайно утраченную адаптивную комбинацию генов или, напротив, объединить несколько вредных мутаций в одну особь, элиминируемую отбором [22, 23].
Нейтральная эволюция и генные сети
Содержание
Изучение проблем скрытой изменчивости и взаимодействия генов в конечном итоге позволили дополнить СТЭ теорией нейтральной эволюции [24], блочно модульной эволюцией [25] и представлением о генных сетях [26].
При независимой адаптивной эволюции по многим локусам под негативный отбор хотя бы по одному из них попадет каждая из особей популяции, что ведет популяцию к гибели (дилемма Холдейна). Для популяций эукариот с характерной эффективной численностью ~10000 особей число одновременно эволюционирующих генов не может превышать 10–15 [25]. Тем более удивительным оказалось открытие методом электрофореза высокого уровня полиморфизма изоферментов и других белковых последовательностей в 60-х годах XX в. М. Кимура предположил, что подавляющее большинство таких молекулярных изменений селективно нейтральны или почти нейтральны [24], а поэтому лежат вне ограничений дилеммы Холдейна. Вследствие этого значительная часть внутривидовой изменчивости (особенно в малых популяциях) объясняется не действием отбора, а случайным дрейфом мутантных аллелей, которые нейтральны.
Из теории нейтральной эволюции следует факт постоянной скорости фиксации нейтральных мутаций в нуклеиновых кислотах и белках (“молекулярные часы”), что позволяет, к примеру, оценивать время расхождения таксонов. При этом роль естественного отбора в развитии жизни на Земле теорией нейтральной эволюции не отрицается, поскольку она действует на молекулярно-биологическом уровне.
Напротив, сложные биохимические и морфофизиологические признаки формируются в результате работы сложных коэкспрессирующихся комплексов генов, выполняющих общую функцию и связанных регуляторными взаимодействиями [27–30]. Позднее для таких комплексов С.Кауфманом был предложен термин “генная сеть” (ГС) [25, 26]. Любая ГС имеет:
1) группу генов (“ядро”), обеспечивающую выполнение ее функций;
2) центральные регуляторы – транскрипционные факторы, координированно регулирующие гены “ядра”, взаимодействуя с сайтами связывания в их регуляторных областях;
3) рецепторы, запускающие работу ГС в ответ на внешние сигналы;
4) пути передачи сигналов с рецепторов ГС на ее центральные регуляторы.
Часть продуктов генов “ядра” ГС также играют роль сигналов, взаимодействуя с рецепторами как собственной ГС, так и других генных сетей и формируя регуляторные контуры с положительными и отрицательными обратными связями [31].
При ограничении, накладываемом дилеммой Холдейна на темпы адаптивной эволюции, актуальным становится блочно-модульный тип эволюции – комбинаторика небольших, относительно автономных генных сетей, каждая из которых ответственна за определенную функцию при формировании того или иного признака (группы признаков). Преимущества блочно-модульной эволюции проявляются, если каждая автономная генная сеть уже апробирована отбором в ходе предшествующей эволюции [25, 32, 33]. Отметим, что такие относительно автономные генные сети формируют определенную иерархию соподчиненных систем, характерные времена эволюционных изменений в которых могут не совпадать, что еще больше увеличивает эволюционную вариабельность [34].
Концепция генных сетей, предложенная в 70-х годах XX в. как математическая модель, объединяющая кибернетические представления об управляющих системах [32, 35] и только что расшифрованные тогда общие принципы реализации генетической информации на молекулярном уровне, оказалась очень плодотворной, позволив, в частности, уже в 80 х годах XX в. начать интеграцию СТЭ и организмоцентрических теорий эволюции, известных в зарубежной научной литературе как направление evodevo (сокращение от англ. evolution и devеlopment) [36–38].
В отличие от СТЭ, признающей редукцию макроэволюции к микроэволюции, в организмоцентрических теориях предполагается качественное различие между микро- и макроэволюцией. Элементарным актом макроэволюции признается не образование репродуктивно изолированных популяций, а качественная перестройка архетипа (интенсионала) организма [39]. Таким образом, могут появляться не только виды, но и надвидовые монотипические таксоны (вплоть до типа), которые затем уже дивергируют на отдельные виды и формируют репродуктивные барьеры. При этом преобразование архетипа рассматривается как очень быстрый процесс, протекающий в течение нескольких поколений за счет так называемых макромутаций (системных мутаций), имеющих ярко выраженный фенотипический эффект.
Формирование репродуктивных барьеров может быть либо следствием системных мутаций (например, при перестройках кариотипа [40, 41]), либо самостоятельным параллельным процессом (что согласуется с существованием множества видов и даже родов, дающих плодовитое потомство не только в эксперименте, но и в природе [42]). Наиболее полно соответствует этому сценарию сальтационная теория эволюции.
А.Н. Северцов и Р. Гольдшмидт [43, 44] предполагали, что такие макромутации (филэмбриогенезы по Северцову) должны изменять либо расположение эмбриональных зачатков (гетеротипии), либо время их закладки (гетерохронии). И.И. Шмальгаузен обобщил этот вывод – в обоих случаях мутации будут менять общерегуляторные системы организмов, изменяя, таким образом, экспрессию множества генов [45]. На язык молекулярной биологии эту идею перевел Ф. Жакоб, предположив, что микроэволюция идет за счет биохимических мутаций (например, мутаций в структурной части оперона), а системные мутации меняют регуляцию генов, (например, возникая в регуляторных районах оперонов) [46].
![Рис. 1. Гомеозисные мутации A. thaliana [65]. а – норма (вид сверху), б – норма (вид сбоку), в – мутация гена AGAMOUS, г – мутация гена PISTILLATA](http://www.socialcompas.com/wp-content/uploads/2016/03/1.jpg)
Рис. 1. Гомеозисные мутации A. thaliana [65]. а – норма (вид сверху), б – норма (вид сбоку), в – мутация гена AGAMOUS, г – мутация гена PISTILLATA
Современные данные в целом подтверждают взгляды Жакоба и Уилсона. Хорошо изученным примером быстрой морфологической эволюции из за мутаций в регуляторном районе является селекция кукурузы из теосинта. Около 7 тыс. лет назад селекционеры-индейцы эмпирически подобрали из разных популяций теосинта комплекс мутаций в промоторе гена tb1 (teosinte branched1), давший строение початка, характерное для современной кукурузы. Интересно, что эти мутации до сих пор существуют в популяциях теосинтов-дикоросов, что позволяет экспериментально повторить процесс [51]. Несмотря на большие анатомоморфологические и поведенческие различия между человеком и шимпанзе, полногеномные сравнения дают оценки межвидовых различий в пределах 1–2%, т.е. не больше чем различие между шимпанзе и другими человекообразными обезьянами [52, 53]. Сравнения различных выборок ортологичных генов человекообразных однозначно указывают на высокий консерватизм их кодирующих последовательностей, давая в среднем расхождение не более двух аминокислот на белок [52, 54].
Сравнение наборов ортологов также позволяет выявить быстро эволюционирующие функциональные группы. Для млекопитающих это гены иммунитета, гены, связанные с репродукцией, гены ольфакторных рецепторов (рецепторов запаха и вкуса) и гены модификации хроматина. У человекообразных приматов к ним добавляются гены транспорта (ионный транспорт, липидный транспорт), гены нервной системы, например связанные с рецепцией боли или со скоростью синаптической передачи, гены транскрипционных факторов и гены раннего эмбриогенеза, в частности ответственные за развитие антериорной части тела [52, 54, 55].
Смена быстро эволюционирующих групп генов в ходе эволюции таксонов заставляет вспомнить блочно-модульный принцип эволюции (см. выше). Расшифровка генных сетей эмбриогенеза животных и растений подтвердила их блочно-модульный характер. Генные сети эмбриогенеза можно разбить на блоки – небольшие генные сети, выполняющие ту или иную элементарную функцию. При этом эти блоки несут различную эволюционную нагрузку: в одних блоках изменчивость и вариабельность является важным условием развития, другие (в частности, регуляторные) блоки являются более консервативными [56]. По видимому, это связано с тем, что ряд ГС входят в качестве блоков во многие другие структуры. Например, ГС апоптоза функционирует в составе ГС онтогенеза [57], ГС иммунного [58] и противоопухолевого ответа [59] и множестве других. Отметим, что блочно модульная концепция была также независимо выдвинута в области эволюционной физиологии [60].
Объединение локальных ГС в более сложные функциональные ансамбли осуществляется с участием особого класса ГС – интеграторов [61], которые в зависимости от стадии развития, ткани и функционального состояния организма могут подключать к выполнению программы те или иные наборы локальных ГС. Одним из важнейших и хорошо изученных интеграторов у животных является ГС Hox-генов, ответственная за морфофункциональную спецификацию сегментов тела и локальную дифференцировку отдельных клеток, тканей и органов внутри сегмента [62], а у цветковых растений – ГС MADS генов, ответственная, в частности, за формирование цветка и соцветий. Мутации Hox генов и MADS генов – гомеозисные мутации, ведут у растений и животных к сходным проявлениям: нарушается либо соотношение органов друг с другом, либо соотношение частей в органе (рис. 1, 2) [63, 64].
![Рис. 2. Гомеозисные мутации D. melanogaster. а – норма (вид с дорсальной стороны), б – норма (фотография головы), в – мутация гена Ultrabithorax (фото E.B. Lewis [66]), г – мутация гена Antennapedia [67]. Молекулярная фи](http://www.socialcompas.com/wp-content/uploads/2016/03/2.jpg)
Рис. 2. Гомеозисные мутации D. melanogaster. а – норма (вид с дорсальной стороны), б – норма (фотография головы), в – мутация гена Ultrabithorax (фото E.B. Lewis [66]), г – мутация гена Antennapedia [67].
Существенным затруднением для сальтационных evo-devo теорий служит низкая жизнеспособность гомеозисных мутантов [72]. Чтобы обойти это затруднение, предлагается несколько эволюционных сценариев. Во первых, в качественных преобразованиях генных сетей большую роль могут играть дупликации, мегадупликации – дупликации протяженных районов геномной ДНК со многими генами и полиплоидизация[3].
Дуплицированная копия может приобрести новые свойства, в то время как ее паралог продолжает выполнять прежние функции. Впервые на это указал С.Оно еще в рамках СТЭ [78]. Кроме того, дупликация может уменьшить степень интегрированности генной сети, когда одни и те же гены участвуют в нескольких блоках, и снизить плейотропный эффект мутаций. Эти соображения, эмпирически высказанные известными эволюционистами Шмальгаузеном [45] и Уоддингтоном [79], подтверждены недавно экспериментально: у млекопитающих гены, экспрессирующиеся в одной ткани, в 3–4 раза чаще фиксируют несинонимичные замены, чем гены, экспрессирующиеся во многих тканях [80].
С другой стороны, если мутации не подвержены отбору, с высокой вероятностью одна из копий станет псевдогеном. Таким образом, необходима функциональная нагрузка обеих копий, например разнесение их экспрессии во времени (экспрессия на разных стадиях развития) и в пространстве (экспрессия в разных органах и тканях[4]) [81–83]. Другой механизм сохранения копий – субфункционализация, когда оба паралога фиксируют мутации, повреждающие комплементарные функции. В результате оба паралога выполняют функцию, с которой раньше справлялся единственный предковый ген (модель DDC – duplication, degradation, complementation) [84]. Наконец, третий механизм связан с фенотипической супрессией – случайным проскоком рибосомой стоп кодона нонсенс мутации [85].
Субфункционализация и фенотипическая супрессия удлиняют “время активной жизни” одной из копий – соответственно растет вероятность случайной мутации, обеспечивающей новую функцию [86, 87].
Следовательно, в данных сценариях предполагается заменить одну макромутацию с ярко выраженным фенотипическим эффектом на серию последовательных мутаций, постепенно все более и более реорганизующих генные сети [72]. При этом возникает другая трудность: мутации в серии происходят независимо одна от другой. Фенотипический же эффект каждой отдельной мутации сравнительно невелик. Соответственно, невелика и ее адаптивная ценность, а значит, скорее всего, такая мутация будет элиминирована.
Поэтому суммарная вероятность осуществления всей серии довольно низка. Это согласуется с экспериментальными данными. Так, полногеномный анализ графа глобальной ГС E. сoli показал, что 272 регуляторные связи в этом графе возникли благодаря дупликациям гена транскрипционного фактора, 128 – благодаря дупликациям гена-мишени, и только 74 – благодаря последовательным дупликациям гена транскрипционного фактора и гена мишени [88].
Таким образом, основное затруднение – независимость изменчивости и отбора. Отбор лишь фиксирует изменчивость, но сам ее не создает.
Один из возможных путей преодоления – это возврат к дарвиновскому представлению о неопределенной изменчивости. Под неопределенной изменчивостью Ч. Дарвин [89] подразумевал признаки с неустойчивым, варьирующим в череде поколений и от особи к особи проявлением (с широкой нормой реакции по современной терминологии). Он отличал их от случайного константного в следующих поколениях изменения признака (именно такие константные изменения Коржинский и Г. де Фриз позднее опишут как мутации [90]).
Позднее дарвиновскую схему подробно разработал И.И. Шмальгаузен [45]. Отбор фиксирует уже существующую наследственную изменчивость не напрямую (мутацию за мутацией в современной терминологии), а канализируя спектр модификационной изменчивости. Сложные морфофизиологические признаки (например, челюстной аппарат) всегда имеют “слабые звенья”, чье небольшое изменение (ключевой ароморфоз [91]) меняет режим функционирования всей системы – дестабилизирует сложившуюся систему онтогенетических корреляций. В результате в популяции изменяется спектр ненаследственной изменчивости – в нем растет число особей с неустойчиво наследуемыми отклонениями от нормы и амплитуда таких отклонений. Созидательная роль стабилизирующего отбора заключается в канализации некоторых из таких лабильных типов онтогенеза. Таким образом, отбор сперва создает неопределенную изменчивость, а затем фиксирует одну из траекторий дестабилизированного онтогенеза путем фиксации мутаций в одном из регуляторных звеньев.
В современной литературе эту схему по дробно разработали Н.Н. Иорданский в системной организмоцентрической концепции макроэволюции [11, 92] и М.А. Шишкин [93, 94] в эпигенетической теории эволюции – ЭТЭ.
Организмоцентрическая и эпигенетическая концепции эволюции
Системная организмоцентрическая концепция макроэволюции предполагает, что эволюция – это системно организованный процесс, включающий качественно неоднородные этапы, причем микро- и макроэволюция представляют соответственно низший и высший уровни его организации [11, 95]. Н.Н. Иорданский также выделяет “по крайней мере два различных уровня макроэволюционных процессов, соответствующих двум этапам становления организации макротаксона.
Высший уровень (или типогенез) представляет совокупность процессов формирования уже упоминавшегося выше комплекса признаков, обычно называемого общим планом строения, архетипом, или типом организации макротаксона. Низший же уровень (или макрогенез) включает макроэволюционные изменения отдельных структур, совокупность которых и создает основу для типогенеза” [11]. Такое деление соответствует данным палеонтологии: комплекс систематических признаков, позволяющий выделить таксон от семейства и выше, никогда не формируется сразу, сальтационно. Отдельные элементы комплекса фиксируются в палеонтологической летописи в различных родственных видах и родах, часто параллельно и лишь в одном-двух филумах комплекс постепенно формируется целиком[5].
М.А. Шишкин [93, 94] различает два способа образования новых структур – силовой и параметрический. В первом случае изменение в системе является однозначным отображением мутации и, следовательно, может быть протестировано отбором непосредственно. Это соответствует эволюции биохимических признаков. Во втором случае мутация переводит систему в неустойчивое состояние, изменяя таким образом вероятность осуществления того или иного варианта ее функционирования.
Таким способом эволюционируют сложные морфофизиологические признаки. При этом непосредственным предметом эволюции являются не отдельные гены, а целостные системы развития (генные сети[6]). Устойчивость и наследуемость нормы, таким образом, – следствие регуляторных взаимодействий внутри системы. На уровне особей материалом отбора служат носители разнонаправленных формообразовательных реакций (морфозов), реализуемых регуляторной компонентой генной сети при стрессовом уклонении условий внешней среды от нормальных, и впоследствии канализируемых отбором. Таким образом, эволюционные изменения в ЭТЭ начинаются с фенотипа, а наследуемость – не партнер естественного отбора, а его продукт, выступающий как целостное свойство нормального развития. Эволюция рассматривается здесь как плата за репарацию онтогенетической устойчивости живой системы, а естественный отбор – как способ поиска ею нового равновесия взамен утраченного.
Стоит отметить, что ряд исследователей подчеркивают необходимость синтеза эпигенетических взглядов с молекулярно генетическими. Например, Л.П. Татаринов в своей работе указывает: “Эпигенетические процессы не носят первичный характер, а надстраиваются над молекулярно генетическими” [100].
Одним из первых такой синтез попытался осуществить М.М. Камшилов, еще в конце 30-х годов XX в. показав на дрозофиле, что во первых, стабилизирующий отбор, не меняя морфологических признаков организма (мутация eyeless), способен изменить их качественные характеристики (рецессивность и доминантность), а также амплитуду экспрессивности и пенетрантности [27– 29, 101]; во вторых – те же характеристики меняются в зависимости от генетического окружения (при введении мутации eyeless в различные генотипы) [102]. Таким образом, отбор, изменчивость и наследуемость оказались взаимосвязанными.
Однако наиболее полно взаимосвязь между отбором и изменчивостью была показана в ходе многолетнего эксперимента по доместикации лисиц [103, 104], норок и соболей [105] и отбора в стрессовых условиях крыс [106]. У всех исследованных видов наблюдалось возрастание темпов и амплитуды модификационной изменчивости.
Однако экспрессивность, пенетрантность и наследуемость вновь возникших признаков оказались неустойчивыми. В ряде случаев эту неустойчивость удалось стабилизировать отбором, получив новые породы пушных зверей [104, 105] и линии экспериментальных животных [106]. Другим важным результатом было повышение частот рекомбинации [107] и мутационной изменчивости [108] и выявление феномена длительных модификаций, связанных с воздействием стрессора (гормональный фон при внутриутробном развитии, хендлинг и присутствие человека при постнатальном онтогенезе) на критические стадии формирования эндокринной системы организма [109, 110]. Таким образом, впервые было показано, что отбор может создавать не только модификационную, но и наследственную изменчивость[7].
Третьим важным результатом стала способность стресса служить провокационным фоном для выявления скрытой изменчивости [104]. Важно, что генетический анализ лишь в редких случаях (ген Star [111]) выявлял специфические гены, ответственные за то или иное отклонение в развитии. В большинстве случаев, наоборот, выявлялся генетический параллелизм (связанный, например, с генами гипоталамо-гипофизарно-надпочечниковой и серотонинэргической систем) различных морфозов у одного вида [104] либо сходных морфозов у разных видов [105]. Объектом отбора в экспериментах школы Д.К. Беляева были не отдельные гены, а нейрогуморальная система в целом, причем не отдельные ее показатели, а суммирующие их параметры (стресс-реактивность, уровень тревожности, уровень исследовательской мотивации). Иными словами, сперва стресс вносил дисбаланс в онтогенетическую систему (дестабилизирующий отбор), а затем шла оптимизация по одному из параметров (стабилизирующий отбор). При этом дестабилизирующий отбор оказался способен коррелятивно сдвигать баланс между системами репарации генома и системами его реорганизации (увеличение частот рекомбинации [107] и транспозиции мобильных элементов [112]).
Теоретическое исследование эволюции регуляторных контуров позволило выявить еще один эффект – обнейтраливание мутаций. В простейшем контуре с отрицательной обратной связью (ООС), регулирующей концентрацию белка, параметр “отклонение концентрации от нормы” отслеживается регуляторным звеном, компенсирующим его, изменяя скорость биосинтеза белка (эффекторное звено ООС). Контуру безразличны причины отклонения от нормы.
![Рис. 3. Роль отрицательных и положительных обратных связей в эволюции. а – качественная картина “обнейтраливания” мутационного спектра под действием отрицательной обратной связи (по оси абсцисс – спектр фенотипической изменчивости, по оси ординат – частота особей определенного фенотипического класса); б, в – конкуренция особей с отрицательной обратной связью (N–) и без нее (N0) в ходе эволюции популяции под действием стабилизирующего отбора (б) и под действием движущего отбора (в). По оси абсцисс отложено число эволюционных шагов, по оси ординат – число особей (численность популяции постоянна – 1000 особей). В начальный момент 50% особей имеют контур с отрицательной обратной связью (N–) и 50% особей не имеют такого контура (N0). По: [34].](http://www.socialcompas.com/wp-content/uploads/2016/03/3.jpg)
Рис. 3. Роль отрицательных и положительных обратных связей в эволюции. а – качественная картина “обнейтраливания” мутационного спектра под действием отрицательной обратной связи (по оси абсцисс – спектр фенотипической изменчивости, по оси ординат – частота особей определенного фенотипического класса); б, в – конкуренция особей с отрицательной обратной связью (N–) и без нее (N0) в ходе эволюции популяции под действием стабилизирующего отбора (б) и под действием движущего отбора (в). По оси абсцисс отложено число эволюционных шагов, по оси ординат – число особей (численность популяции постоянна – 1000 особей). В начальный момент 50% особей имеют контур с отрицательной обратной связью (N–) и 50% особей не имеют такого контура (N0). По: [34].
Экосистемная теория эволюции и теория прерывистой эволюции
В 1972 г. палеонтологами Н. Элдриджем и С. Гулдом была предложена теория прерывистой эволюции (пунктуализм), занимающая промежуточное положение между сальтационизмом и классическим градуализмом. Согласно этой теории, становление новых таксонов происходит в ходе редких периодов интенсивной дивергенции (эволюционный взрыв, кладогенез), чередующихся с длительными периодами – стазисами, в которых существенных изменений не происходит [117]. Однако, отметив явление стазиса, Элдридж и Гулд не предложили механизмов этого явления. Различные объяснения механизмов стазиса были предложены в рамках системной организмоцентрической концепции макроэволюции (см. выше) и экосистемной теории эволюции.
Экосистемная теория эволюции, представляющая собой синтез экологии и эволюционного течения, в основном основывается на работах советских и российских ученых-эволюционистов В.А. Красилова, С.М. Разумовского, В.В. Жерихина и других. В отличие от описанных выше эволюционных теорий, экосистемная теория считает содержанием макроэволюции формирование биогеоценозов и биомов, которое по правилу ниш Гаузе [118] активизирует диверсификацию таксонов. Следовательно, экосистемная теория эволюции по большому счету не интересуется механизмами преобразования генетической информации, но ставит скорость и масштаб этих преобразований в зависимость от филоценогенетических процессов – процессов закономерного изменения (эволюции) экосистем разного уровня.
Такая постановка вопроса позволяет объяснить множество противоречий между данными экспериментальной и популяционной генетики и полевыми исследованиями. Так, скорость эволюции (количество эволюционного изменения за единицу времени [5]), согласно данным генетики, должна в первом приближении положительно коррелировать со скоростью размножения и “оборота” жизненного цикла [3, 5] и размером и структурированностью популяций [119, 15].
Между тем количественный подсчет “времени полураспада таксона” по данным палеонтологии показал, что быстрее всех формировались роды и семейства мегафауны (хоботные, носороги), немного медленнее – крупных копытных и далее [120] вплоть до прокариот, формирование основных систематических групп которых завершилось в докембрии и с тех пор практически не менялось [121, 122]. А.П. Расницын объяснил это противоречие, связав скорость эволюции с экологической пластичностью таксона. Пока вид в состоянии найти себе пригодный для жизни биотоп, он не эволюционирует [120].
Это объяснение хорошо согласуется с ролью стресса в эволюции. Первой попыткой адаптации организма к неспецифически изменившимся условиям среды будет модификационная изменчивость [123, 124]. У высших многоклеточных она часто реализуется как ростовая реакция, например морфоз или квазисенильность у растений [125], наконец, у подвижных организмов с высокоразвитой нервной системой – как поведенческая реакция [126, 127]. Вскрытая стрессом изменчивость (см. выше) способна повысить дисперсию в популяциях медленно размножающихся видов и тем самым кратковременно увеличить темпы их эволюции.
Таким образом, именно формирование и эволюция экосистем определяют скорость и канализирование эволюции популяций, видов и надвидовых таксонов [121, 128, 129]. Сама эволюция рассматривается как процесс создания и/или диверсификации экологических ниш. Процесс эволюции в равной степени зависит как от генетических факторов (популяционная генетика, микрои макромутации и т.д.), так и от экологических (сбалансированность сукцессионных процессов в масштабе биогеоценоза, биома, биосферы) [121, 130–134]. Так, в экосистемной теории рассматриваются когерентные и некогерентные эволюционные процессы. Когерентная эволюция идет в условиях устойчивой экоценотической структуры (полночленные экосистемы с хорошо заполненными трофическими уровнями, сбалансирован ные сукцессионные процессы) и предполагает дальнейшее усиление специализации вида в пределах его экологической ниши, что ведет к возрастанию плотности упаковки ниш, возрастанию роли симбиотических отношений и коадаптации и, как следствие, замедлению сперва масштабов эволюции (падение вероятности формирования крупных таксонов, зато высокая скорость диверсификации уже существующих таксонов на все более и более мелкие субтаксоны), а затем и ее темпов (замедление таксонообразования, впадение таксонов в стазис).
Некогерентная эволюция, напротив, характеризуется ослаблением внутри ценотических связей, рассогласованием адаптаций и ускорением эволюционных темпов. Данная ситуация возникает либо при ценотических кризисах, либо в зонах постоянных нарушений экологического ландшафта (зоны экотона, горные районы и т.д.) [135–138]. Однако в настоящее время идеи экосистемной эволюции пока не вышли за рамки сравнительно узкого круга исследователей. Интеграция их с другими эволюционными теориями только начинается [139].
Симбиогенная теория эволюции
Концепция симбиогенеза – происхождения новых таксонов путем аккумулирования геномов разных, ранее репродуктивно изолированных ветвей впервые была сформулирована в начале XX в. К.С. Мережковским и А.С. Фаминцыным [140–142]. Ими была выдвинута гипотеза симбиогенетического происхождения клеток зеленых растений. В частности, Мережковский предположил, что клетки цианобактерий могли быть вероятными предшественниками хлоропластов и, соответственно, фотосинтезирующая клетка зеленых растений имеет симбиогенное происхождение. Следствием симбиогенетической теории является признание полифилии органического мира как минимум на уровне царств. Дальнейшее развитие данной теории произошло в 50–60 х годах XX века и было связано с развитием генетики и средств электронной микроскопии. Было обнаружено принципиальное различие в строении ядерной ДНК эукариот и кольцевой ДНК прокариот, а также сходство ДНК внеядерных органелл с ДНК прокариот. Более того, органеллы оказались способными к авторепродукции [143, 144]. Наиболее глубокое развитие концепций симбиогенеза на данном этапе было проведено Л. Саган Маргулис [143, 145] и Т. Кавалье Смит. Последний сформулировал [146, 147] гипотезу о происхождении эукариотической клетки в результате серии последовательных актов симбиогенеза в предковом прокариотическом сообществе. Одним из важных этапов развития теории симбиогенеза было открытие горизонтального переноса генов между организмами [148, 149] и дальнейшее изучение его эволюционной роли – как для прокариот (в основном) [150–153], так и для эукариот [152, 154].
Первой предпосылкой симбиогенеза послужила утрата в одной из линий прокариот экзоскелета (неомуральная революция) (рис. 4). Предки архей восстановили экзоскелет на базе гликопротеинов (что впоследствии помогло освоить им экстремальные биотопы). Предки эукариот развили внутренний лабильный эндоскелет на базе комплексов актин-миозина и тубулин-динина[9]. Лабильный эндоскелет и возникшие на его основе универсальные клеточные моторы (актомиозиновый и тубулин-дининовый) позволили освоить принципиально новый тип питания – фагоцитоз, ставший второй предпосылкой симбиогенеза. Участки генома фагоцитируемой добычи и послужили материалом массового горизонтального переноса, а предки митохондрий и хлоропластов приспособились существовать в цитоплазме[10] [146, 147].
Современный комплексный анализ геномов, протеомов и метаболомов подтвердил эту гипотезу [158]. Если среди генов домашнего хозяйства эукариот оказалась большая доля гомологов генов архей, то базовые метаболические процессы были позаимствованы у эубактерий. В горизонтальный перенос в ходе симбиогенеза вовлекались гены систематически далеких бактерий из разных трофических групп. Фактически в ходе симбиогенеза существенные фрагменты гибридной генной сети совокупного метаболизма бактериального мата оказались перенесены в один геном [158]. По-видимому, в разных предковых филумах эукариот этот процесс шел параллельно и независимо [159, 160]. В настоящее время, в свете большого объема вновь появляющихся молекулярно-генетических данных, дискуссии по поводу роли симбиогенеза в эволюции продолжаются [161, 162].
Так, согласно С.В. Шестакову, основным трендом эволюции организмов в прокариотических сообществах является деградация: геномы бактерий постоянно теряют гены. Горизонтальный перенос является естественным противовесом деградации, сохраняя таким образом общий пул функций того или иного бактериального сообщества [163, 164]. Таким образом, прогрессивно эволюционировать или подвергаться стабилизирующему отбору может лишь сообщество в целом.
При этом частота горизонтального переноса может повышаться при стрессе, как за счет активации транспозонов [112], так и за счет автолизиса части бактериальной популяции с последующим поглощением “останков” выжившими [165, 166]. Однако полногеномный анализ взаиморасположения генов в бактериальных “хромосомах” [167] и анализ графов полных генных сетей прокариот [168] свидетельствуют об их консервативности.
Гены чужаки не рассеяны по геному, а сконцентрированы в специальных “островках” [153]. Часто такие островки располагаются в районе старта репликации или повторов, т.е. там, где наиболее вероятна рекомбинация [169]. Таким образом, геном прокариот содержит как лабильные, так и устойчивые по информационному содержанию участки, а сами таксоны прокариот сохраняют эволюционную самостоятельность в сообществе.
Большую дискуссию в свое время возбудила роль горизонтального переноса в эволюции высших многоклеточных эукариот [170]. Современные данные заставляют предположить, что если горизонтальный перенос между высшими эукариотами и происходит, то довольно редко и без существенных эволюционных последствий [171].
Напротив, эксплуатация эукариотами генов эндогенных ретровирусов, часто необратимо встраивавшихся в геном [66], может привести даже к ароморфозам. Так, ген синцитин, обеспечиваю щий нормальное развитие плаценты у млекопитающих, является потомком умеренного (лизогенного) вируса [154]. Гены RAG1 и RAG2, участвующие в механизме рекомбинации генов антигенных рецепторов лимфоцитов [172], остатки транспозона, встроившегося ~400 млн. лет на зад в геном гермальных клеток предков челюстноротых и утратившего транспозазу. Исходной их функцией могла быть защита вируса в клетке от
внедрения других вирусов или от атак иммунной системы хозяина. Наконец, ретровирусные последовательности могли участвовать в формировании механизма инактивации X хромосомы у млекопитающих [139].
Коэволюционные теории эволюции
Совместная эволюция взаимодействующих видов – коэволюция – в настоящее время рассматривается исследователями на нескольких уровнях организации: межорганизменный уровень – соответствующий представлениям экосистемной теории эволюции. Например, системы вида хищник–жертва, цвет ковые растения–опылители и т.д. [89, 173–175]; межгеномный уровень – отчасти соответствующий представлениям симбиогенетической концепции. Например, коэволюция генов (и белков) рецепции и адсорбции в системах фаг–бактерия, антиинфекционный “пассивный” конституциональный молекулярный иммунитет, отбирающий устойчивые формы хозяина на популяционном уровне, и др. [34, 176, 177]; внутригеномный уровень – согласованная эволюция семейств повторенных последовательностей, в т.ч. мультигенных семейств [178–180], возникновение и фиксация пар коадаптивных нуклеотидных и аминокислотных замен в молекулах РНК и белков, сохраняющих их функции и структуру, коадаптивные изменения в функциональных сайтах белков [181–184] и коэволюция регуляторных сайтов генов и соответствующих белков и кофакторов, распознающих эти сайты [185, 186].
Недарвиновские теории эволюции
В заключение кратко рассмотрим основные недарвиновские теории эволюции. Теория, сформулированная Ж.Б. Ламарком в начале XIX в., была первой целостной концепцией эволюции [142].
Основные тезисы ламаркизма: 1) стремление живых существ к совершенству, понимаемому как увеличение разнообразия способностей взаимодействовать с внешней средой (отсюда вырос психоламаркизм); 2) это стремление реализуется вследствие возможности “наследования благоприобретенных признаков” (адаптивных модификаций, в современной терминологии) благодаря “упражнению” и “неупражнению” различных органов (отсюда вырос механоламаркизм); 3) результаты такой “тренировки” передаются потомству, причем у раздельнополых видов – благодаря “подбору пар”, тренирующих признаки в одном и том же направлении [6, 142].
Показательно, что это упоминание Ламарком об отборе как факторе эволюции (!) впоследствии совершенно выпало из поля зрения как его последователей, так и критиков.
Номогенез – эволюционная теория, предложенная Л.С. Бергом, предполагает, что таксоны развивались полифилетично, преимущественно конвергентно (редко – дивергентно) из множества первичных форм, на основе закономерностей, зафиксированных в пространственных структурах белков. Набор таких законов, как и набор конформаций, ограничен, задавая, таким образом, пространство возможностей для эволюции, что и обеспечивает, например, повторяемость изменчивости, выраженную в гомологических рядах Н.И.Вавилова. Естественному отбору при этом отводится роль стабилизирующего, а не прогрессивного фактора [7].
В 1917 г. математиком Д’Арси Томпсоном в труде “О росте и форме”, посвященном применению математических методов к исследованию геометрических форм и процессов роста животных и растительных организмов, был выдвинут тезис: биологи переоценивают роль эволюции и недооценивают роль законов физики и механики в организации живых организмов [187]. В качестве примеров приводится подобие форм медуз и капель жидкости, падающих в вязкой среде, или подобие внутренних поддерживающих структур трубчатых костей птиц и инженерных конструкций опорных ферм. Кроме этого, Томпсоном было проведено сравнение филлотаксиса (количественных отношений между спиральным расположением листьев и связанных с ним структур у растений) и последовательностей Фибоначчи.
Аналогичные идеи в своей концепции автоэволюции высказывает и современный автор А. Лима-де-Фариа, отрицающий идею естественного отбора и рассматривающий биологическую эволюцию как закономерное продолжение предбиологической эволюции, определяющей основное направление развития живого [188].
Заключение
В обзоре рассмотрены основные теории биологической эволюции и их взаимосвязь, которая возрастает по мере проникновения в нее системной биологии и, в частности, такой ее области, как теория генных сетей. Дальнейшее развитие эволюционного учения, как нам кажется, будет связано, прежде всего, с синтезирующей ролью системной биологии.
Авторы выражают благодарность рецензенту за квалифицированную оценку, которая помогла нам улучшить статью.
Список литературы
- Любищев А.А. О постулатах современного селектогенеза. Проблемы эволюции. Новосибирск: Наука, 1973. Т. 3. С. 31–56.
- Костерин О.Э., Колесникова Т.Д. О чем писал Дарвин // Вестник ВОГиС. 2009. Т. 13. No 2. С. 448– 479.
- Тимофеев Ресовский Н.В., Воронцов И.Н., Яблоков А.В. Краткий очерк теории эволюции. М.: Наука, 1977. 297 с.
- Дубинин Н.П. Общая генетика. М.: Наука, 1986. 560 с.
- Грант В. Эволюционный процесс: Критический обзор эволюционной теории / Пер. с англ. М.: Мир, 1991. 488 с.
- Ламарк Ж.Б. Избранные произведения (в 2 т.). М.: Изд во АН СССР, 1955–1959. 968 с.
- Берг Л.С. Труды по теории эволюции, 1922–1930. Л.: Наука, 1977. 387 с.
- Корочкин Л.И. Онтогенез, эволюция и гены // Природа. 2002. No 7. С. 10–19.
- Левонтин Р. Генетические основы эволюции. М.: Мир, 1978. 351 с.
- Ли Ч. Введение в популяционную генетику. М.: Мир, 1978. 555 с.
- Иорданский Н.Н. Макроэволюция: макрогенез и типогенез // Журн. общей биологии. 2004. Т. 65. No 6. С. 451–463.
- Гродницкий Д.Л. Две теории биологической эволюции. Саратов: Изд во “Научная книга”, 2001. 160 с.
- Тимофеев Ресовский Н.В. О взаимоотношениях микро- и макроэволюции. // Микро и макроэволюция. Тарту: Изд во ТГУ, 1980. С. 51–57.
- Яблоков А.В. Существует ли специальный механизм макроэволюции? // Микро и макроэволюция. Тарту: Изд во ТГУ, 1980. С. 62–64.
- Майр Э. Популяции, виды и эволюция. М.: Мир, 1974. 460 с.
- Yang Z., Swanson W.J., Vacquier V.D. Maximum likelihood analysis of molecular adaptation in abalone spermlysin reveals variable selective pressures among lineages and sites // Mol. Biol. Evol. 2000. V. 17. No 10. P. 1446–1455.
- Wyckoff G.J., Wang W., Wu C.I. Rapid evolution of male reproductive genes in the descent of man // Nature. 2000. V. 403. No 6767. P. 304–309.
- Wright S. Evolution in Mendelian populations // Genetics. 1931. V. 16. No 1. P. 97–159.
- Huxley J.S. Evolution. The modern synthesis. 2 nd ed. London: Publ.; N.Y.: Harper & Brothers, 1943. 645 p.
- Колчанов Н.А., Шиндялов И.Н. Теоретическое исследование эволюции регуляторных контуров при различных типах отбора // Проблемы генетики и теории эволюции / Под ред. Шумного В.К., Колчанова Н.А., Рувинского А.О. Новосибирск: Наука, 1991. С. 268–279.
- Бердников В.А. Основные факторы макроэволюции. Новосибирск: Наука, 1990. 253 с.
- Muller H.J. The relation of recombination to mutational advance // Mutant. Res. 1964. V. 1. P. 2–9.
- Kondrashov A.S. Deleterious mutations and the evolution of sexual reproduction // Nature. 1988. V. 336. No 6198. P. 435–440.
- Кимура М. Молекулярная эволюция: теория нейтральности. М.: Мир, 1985. 400 с.
- Ратнер В.А., Жарких А.А., Колчанов Н.А. и др. Проблемы теории молекулярной эволюции. Новосибирск: Наука, 1985. 260 с.
- Kauffman S.A. Gene regulation networks: A theory for their global structure and behaviors // Current Topics in Developmental Biology. N.Y.: Acad. Press, 1977. V. 6. P. 145–182.
- Камшилов М.М. Отбор как фактор, меняющий зависимость признака от изменений внешних условий // ДАН. 1939. T. 23. No 4. С. 361–364.
- Камшилов М.М. Проявление признака и изменчивость. Эффект порога проявления // ДАН. 1940. Т. 26. No 6. С. 605–608.
- Камшилов М.М. Изменчивость и проявление. Проблема нормального фенотипа // ДАН. 1940. Т. 29. No 3. С. 239–243.
- Мазер К., Джинкс Дж. Биометрическая генетика. М.: Мир, 1985. 463 с.
- Колчанов Н.А., Ананько Е.А., Колпаков Ф.А. и др. Генные сети // Молекуляр. биология. 2000. Т. 34. No 4. С. 533–544.
- Ратнер В.А. Генетика. Молекулярная кибернетика: Личности и проблемы. Новосибирск: Наука, 2002. 272 с.
- Гунбин К.В., Суслов В.В., Колчанов Н.А. Ароморфозы и адаптивная молекулярная эволюция // Информац. вестник ВОГиС. 2007. Т. 11. No 2. С. 373–400.
- Букварёва Е.Н., Алещенко Г.М. Схема усложнения биологической иерархии в случайной среде // Успехи соврем. биологии. 1997. Т. 117. No. 1. С. 18–32.
- Эшби У.Р. Введение в кибернетику. М.: Изд-во иностр. лит ры, 1959. 432 с.
- Carroll S.B. Homeotic genes and the evolution of arthropods and chordates // Nature. 1995. V. 376. No 6540. P. 479–485.
- Carroll S.B. Endless Forms Most Beautiful. The New Science of Evo Devo and the Making of the Animal Kingdom. N.Y.: W.W. Norton & Co., 2005. 350 p.
- Gerhart J., Kirschner M. Cells, Embryos and Evolution. Oxford: Blackwell Sci., 1997. 642 p.
- Васильева Л.Н. Кризис проблемы вида: причины и следствия // Эволюционная биология. Томск, 2002. Т. 2. С. 31–50.
- Стегний В.Н. Системная реорганизация генома при видообразовании // Эволюционная биология: Материалы конф. “Проблема вида и видообразования”. Томск: Томский гос. ун т, 2001. Т. 1. С. 128–137.
- Трифонов В.А., Перельман П.Л., Романенко С.А., Графодатский А.С. Эволюционно цитогенетическое разнообразие // Биоразнообразие и динамика экосистем / Под ред. Шумного В.К., Шокина Ю.И., Колчанова Н.А., Федотова А.М. Новосибирск: Изд во СО РАН, 2006. С. 361–367.
- Терновский Д.В. Биология куницеобразных. Новосибирск: Наука, 1977. 280 с.
- Goldschmidt R. The material basis of evolution. New Heaven: Yale Univ. Press, 1940. 436 p.
- Goldschmidt R. Ecotype, ecospecies and macroevolution // Experientia Suppl. 1980. V. 35. P. 140–153.
- Шмальгаузен И.И. Факторы эволюции (Теория стабилизирующего отбора). М.: Наука, 1968. 452 с.
- Jacob F. Evolution and tinkering // Science. 1977. V. 196. No 4295. P. 1161–1166.
- Wilson A.C., Maxson L.R., Sarich V.M. Two types of molecular evolution. Evidence from studies of interspecific hybridization // PNAS. 1974. V. 71. No 7. P. 2843–2847.
- Prager E.M., Wilson A.C. Slow evolutionary loss of the potential for intersspecific hybridization in birds: a manifestation of slow regulatory evolution // PNAS. 1975. V. 72. No 1. P. 200–204.
- Wilson A.C., Sarich V.M., Maxson L.R. The importance of gene rearrangement in evolution: evidence from studies on rates of chromosomal, protein, and anatomical evolution // PNAS. 1974. V. 71. No 8. P. 3028–3030.
- King M.C., Wilson A.C. Evolution at two levels in humans and chimpanzees // Science. 1975. V. 188. No 4184. P. 107–116.
- Wang R.L., Stec A., Hey J. et al. The limits of selection during maize domestication // Nature. 1999. V. 398. No 6724. P. 236–239.
- Wildman D.E., Uddin M., Liu G. et al. Implications of natural selection in shaping 99.4% nonsynonymous DNA identity between humans and chimpanzees: enlarging genus Homo // PNAS. 2003. V. 100. No 12. P. 7181–7188.
- Glazko G., Veeramachaneni V., Nei M., Maka lowski W. Eighty percent of proteins are different between humans and chimpanzees // Gene. 2005. V. 346. P. 215–219.
- Chimpanzee Sequencing and Analysis Consortium. Initial sequence of the chimpanzee genome and comparison with the human genome // Nature. 2005. V. 437. No 7055. P. 69–87.
- Arbiza L., Dopazo J., Dopazo H. Positive selection, relaxation, and acceleration in the evolution of the human and chimp genome // PLoS Comput. Biol. 2006. V. 2. No 4. e38. Epub 2006. Apr 28.
- Cherdantsev V.G., Skobeeva V.A. The within individual basis of between individual differences // Информ. вестник ВОГиС. 2009. Т. 13. No 1. С. 144–149.
- Meier P., Finch A., Evan G. Apoptosis in development // Nature. 2000. V. 407. No 6805. P. 796–801.
- Krammer P. H. CD95’s deadly mission in the immune system // Nature. 2000. V. 407. No 6805. P. 789–795.
- Lowe S.W., Lin A.W. Apoptosis in cancer // Carcinogenesis. 2000. V. 21. No 3. P. 485–495.
- Уголев А.М. Эволюция пищеварения и принципы эволюции функций. Л.: Наука, 1985. 544 с.
- Степаненко И.Л. Регуляция генных сетей стрессового ответа активными формами кислорода // Экологич. генетика. 2004. Т. 2. No 1. С. 4–12.
- Abouheif E., Wray G.A. Evolution of the gene network underlying wing polyphenism in ants // Science. 2002. V. 297. No 5579. P. 249–252.
- Raff R.A., Sly B.J. Modularity and dissociation in the evolution of gene expression territories in
development // Evol. Dev. 2000. V. 2. No 2. P. 102–113.
- Richardson M.K., Keuck G. Haeckel’s ABC of evolution and development // Biol. Rev. Camb. Philos. Soc. 2002. V. 77. No 4. P. 495–528.
- Ayala F.J., Rzhetsky A., Ayala F.J. Origin of the metazoan phyla: molecular clocks confirm paleontological estimates // PNAS. 1998. V. 95. No 2. P. 606–611.
- Brosius J. Genomes were forged by massive bombard ments with retroelements and retrosequences // Genetica. 1999. V. 107. No 1–3. P. 209–238.
- Biehs B., Sturtevant M.A., Bier E. Boundaries in the Drosophila wing imaginal disc organize vein specific genetic programs // Development. 1998. V. 125. No 21. P. 4245–4257.
- Ferrier D.E., Holland P.W. Ancient origin of the Hox gene cluster // Nat. Rev. Genet. 2001. V. 2. No 1. P. 33– 38.
- Balavoine G., de Rosa R., Adoutte A. Hox clusters and bilaterian phylogeny // Mol. Phylogenet. Evol. 2002. V. 24. No 3. P. 366–373.
- Peterson K.J., Eernisse D.J. Animal phylogeny and the ancestry of bilaterians: inferences from morphology and 18S rDNA gene sequences // Evol. Dev. 2001. V. 3. No 3. P. 170–205.
- Lawton Rauh A.L., Alvarez Buylla E.A., Purugganan M.D. Molecular evolution of flower development // Trends Ecol. Evol. 2000. V. 15. No 4. P. 144–149.
- Akam M. Hox genes, homeosis and the evolution of segment identity: no need for hopeless monsters // The Int. J. of Developmental Biology. 1998. V. 42. No 3. P. 445–451.
- Piskur J. Origin of the duplicated regions in the yeast genomes // Trends Genet. 2001. V. 17(6). P. 302–303.
- Paterson A.H., Bowers J.E., Chapman B.A. Ancient polyploidization predating divergence of the cereals, and its consequences for comparative genomics // PNAS. 2004. V. 101. No 26. Р. 9903–9908.
- De Souza F.S., Bumaschny V.F., Low M.J. et al. Subfunctionalization of expression and peptide domains following the ancient duplication of the proopiomel anocortin gene in teleost fishes // Mol. Biol. Evol. 2005. V. 22. No 12. P. 2417–2427.
- Sharma M.K., Liu R.Z., Thisse C. et al. Hierarchical subfunctionalization of fabp1a, fabp1b and fabp10 tis sue specific expression may account for retention of these duplicated genes in the zebrafish (Danio rerio) genome // FEBS J. 2006. V. 273. No 14. P. 3216–3229.
- Prince V.E., Pickett F.B. Splitting pairs: the diverging fates of duplicated genes // Nat. Rev. Genet. 2002. V. 3. No 11. P. 827–837.
- Оно С. Генетические механизмы прогрессивной эволюции. М.: Мир, 1973. 228 с.
- Waddington C.H. The Evolution of an Evolutionist. N.Y.: Cornell Univ. Press, Ithaca, 1975. 219 p.
- Duret L., Mouchiroud D. Determinants of substitution rates in mammalian genes: expression pattern affects selection intensity but not mutation rate // Mol. Biol. Evol. 2000. V. 17. No 1. P. 68–74.
- Родин C.Н., Пахомчук Д.В., Риггс А.Д. Эпигенетические изменения и репозиционирование определяют эволюционную судьбу дуплицированных генов // Биохимия. 2005. Т. 70. No 5. С. 680–689.
- Liu R.Z., Sharma M.K., Sun Q. et al. Retention of the duplicated cellular retinoic acid binding protein1 genes (crabp1a and crabp1b) in the zebrafish genome by subfunctionalization of tissue specific expression // FEBS J. 2005. V. 272. No 14. P. 3561–3571.
- Kle’ver N., Kondo M., Herpin A. et al. Divergent expression patterns of Sox9 duplicates in teleosts indicate a lineage specific subfunctionalization // Dev. Genes Evol. 2005. V. 215. No 6. P. 297–305.
- Lynch M., Force A. The probability of duplicate gene preservation by subfunctionalization // Genetics. 2000. V. 154. No 1. P. 459–473.
- Тиходеев О.Н., Гетманова Е.В., Тихомирова В.Л., Инге Вечтомов С.Г. Неоднозначность трансляции у дрожжей: генетический контроль и модификации // Молекулярные механизмы генетических процессов. М.: Наука, 1990. С. 218–228.
- Torgerson D.G., Singh R.S. Rapid evolution through gene duplication and subfunctionalization of the testes specific alpha4 proteasome subunits in Drosophila // Genetics. 2004. V. 168. No 3. P. 1421–1432.
- He X., Zhang J. Rapid subfunctionalization accompanied by pro longed and substantial neofunctionalization in duplicate gene evolution // Genetics. 2005. V. 169. No 2. P. 1157–1164.
- Teichmann S.A., Babu M.M. Gene regulatory network growth by duplication // Nat. Genet. 2004. V. 36. No 5. P. 492–496.
- Дарвин Ч. Происхождение видов путем естественного отбора. СПб.: Наука, 1991. 539 c.
- Филипченко Ю.А. Эволюционная идея в биологии. М.: Наука, 1977. 227 с.
- Osborn H.F. The continuous origin of certain unit characters as observed by a paleontologist // Harvey Lectures. Ser., Philadelphia: Press J.B. Lippincott Comр., 1911 1912. P. 153–204.
- Иорданский Н.Н. Макроэволюция: Системная теория. М: Наука, 1994. 112 с.
- Шишкин М.А. Эволюция как эпигенетический процесс // Современная палеонтология / Под ред. Меннера В.В., Макридина В.П. М.: Недра, 1988. С. 142–169.
- Шишкин М.А. Закономерности эволюции онтогенеза // Современная палеонтология / Под ред. Меннера В.В., Макридина В.П. М.: Недра, 1988. С. 169–209.
- Астафьев А.К., Говорунов А.В. Методология исследования макроэволюции и проблема критериев прогресса // Микро и макроэволюция. Тарту: Изд во ТГУ, 1980. С. 145–149.
- Клек Д. Трудный путь на сушу // В мире науки. 2006. No 3. С. 52–59.
- Татаринов Л.П. Морфологическая эволюция териодонтов и общие вопросы филогенетики. М.: Наука, 1976. 257 с.
- Курочкин Е.Н. Параллельная эволюция тероподных динозавров и птиц // Зоол. журн. 2006. Т. 85. No 3. С. 283–297.
- Лавров А.В., Потапова Е.Г. “Dinofelis” (Felidae) – особое звено в эволюции хищных млекопитающих // Современные проблемы биологической эволюции. М.: ИПЭЭ РАН, 2007. С. 29–30.
- Татаринов Л.П. Молекулярная генетика и эпигенетика в механизмах морфогенеза // Журн. общей биологии. 2007. Т. 68. No 3. С. 165–169.
- Камшилов М.М. Отбор в различных условиях проявления признака // Биол. журн. 1935. Т. 4. No 6. С. 1005–1013.
- Камшилов М.М. Эволюция биосферы. 2 е изд. М.: Наука, 1974. 256 с.
- Беляев Д.К. О некоторых проблемах коррелятивной изменчивости и их значении для теории и селекции животных // Изв. СО АН СССР. Сер. биол. мед. наук. 1962. No 10. С. 111–124.
- Трут Л.Н. Эволюционные идеи Д.К. Беляева как концептуальный мост между биологией, социологией и медициной // Вестник ВОГиС. 2008. Т. 12. No 1/2. С. 7–17.
- Трапезов О.В. Регуляторные эффекты генов поведения и управление окрасочным формообразованием у американских норок (Mustela vison Schreber, 1777) // Вестник ВОГиС. 2008. Т. 13. No 1/2. С. 63–82.
- Маркель А.Л. Стресс и эволюция // Вестник ВОГиС. 2008. Т. 12. No 1/2. С. 206–215.
- Бородин П.М., Беляев Д.К. Влияние стресса на частоту кроссинговера во 2 й хромосоме домовой мыши // Докл. АН СССР. 1980. Т. 253. No 3. С. 727–729.
- Бородин П.М. Стресс и генетическая изменчивость // Генетика. 1987. Т. 23. No 6. С. 1003–1010.
- Vadlamudi S., Kalhan S.C., Patel M.S. Persistence of metabolic con sequences in the progeny of rats fed a HC formula in their early postnatal life // Am. J. Phys iol. 1995. V. 269. No 4. P. 731–738.
- Srinivasan M., Laychock S.G., Hill D.J., Patel M.S. Neonatal nutrition: metabolic programming of pancreatic islets and obesity // Exp. Biol. Med. (May wood). 2003. V. 228. No 1. P. 15–23.
- Беляев Д.К., Трут Л.Н. Генетические взаимоотношения специфических изменений стандартной окраски серебристо черных лисиц (“подпалов” и “звездочки”), возникших в процессе доместикации // Генетика. 1986. Т. 22. No 1. С. 119–128.
- Ратнер В.А., Васильева Л.А. Мобильные генетические элементы (МГЭ) и эволюция геномов // Современные проблемы теории эволюции / Под ред. Татаринова Л.П. М.: Наука, 1993. С. 43–59.
- Креславский А.Г. Новый взгляд на адаптивную природу полиморфизма. Концепция псевдонейтральных мутаций // Журн. общей биологии. 1993. Т. 54. No 6. С. 645–658.
- Суслов В.В., Колчанов Н.А. Дарвиновская эволюция и регуляторные генетические системы // Вестник ВОГиС. 2009. Т. 13. No 2. С. 410–439.
- Горлов И.П., Горлова О.Ю. Движущий отбор в ходе эволюции человека // Вестник ВОГиС. 2007. Т. 11. No 2. С. 363–372.
- Шумный В.К., Шокин Ю.И., Колчанов Н.А., Федотов А.М. (ред.) Биоразнообразие и динамика экосистем. Новосибирск: Изд во СО РАН, 2006. С. 21–94.
- Eldredge N., Gould S.J. Punctuated equilibria: an alternative to phyletic gradualism // Models in Paleobiology / Ed. Schopf T.J.M. San Francisco: Freeman, Cooper and Comр., 1972. P. 82–115.
- Гаузе Г.Ф. Борьба за существование. Ижевск: Ин-т компьютерных исслед., 2002. 160 с.
- Колмогоров А.Н. Уклонение от формул Харди при частичной изоляции // Докл. АН СССР. 1935. Т. 3. No 7. С. 129–132.
- Расницын А.П. Темпы эволюции и эволюционная теория (гипотеза адаптивного компромисса) // Эволюция и биоценотические кризисы. М.: Наука, 1987. С. 46–64.
- Заварзин Г.А. Становление биосферы // Вестник РАН. 2001. Т. 71. No 11. С. 988–1001.
- Заварзин Г.А. Эволюция геосферно-биосферной системы // Природа. 2003. No 1. С. 27–35.
- Гаузе Г.Ф. Экология и некоторые проблемы происхождения видов // Экология и эволюционная теория. Л.: Наука, 1984. С. 5–108.
- Полянский Ю.И. О закономерностях микро- и макроэволюции у одноклеточных эукариот // Проблемы генетики и теории эволюции. / Под ред. Шумного В.К., Колчанова Н.А., Рувинского А.О. Новосибирск: Наука, 1991. С. 229–241.
- Полевой В.В. Физиология растений: Учебник для биол. спец. вузов. М.: Высш. шк., 1989. 464 с.
- Беляев Д.К. Дестабилизирующий отбор как фактор изменчивости при доместикации животных // Природа. 1979. No 2. С. 36–45.
- Маркель А.Л. Современные концепции эволюционной генетики // Стресс и эволюция: концепция Д.К. Беляева и ее развитие / Под ред. Шумного В.К., Маркеля А.Л. Новосибирск: ИЦиГ СО РАН, 2000. С. 103–114.
- Красилов В.А. Нерешенные проблемы теории эволюции. Владивосток: ДВНЦ АН СССР, 1986. 138 с.
- Старобогатов Я.И. О соотношениях между микро и макроэволюцией // Дарвинизм: история и современность. Л.: Наука, 1988. С. 138–145.
- Günter K. Über Evolutionfaktoren und die Bedeutung des Begriffs “ökologische Lizenz” für die Erklärung von Formenerscheinungen in Tier reichs // Ornithologie als biologische Wissenschaft. 28. Beiträge als Festschrifl zum 60. Geburtstag von Erwin Stresemann (22 November, 1949). Heidelberg: C. Winter Universitätsverlag, 1949. P. 23–54.
- Левченко В.Ф. Модели в теории биологической эволюции. СПб.: Наука, 1993. 384 с.
- Старобогатов Я.И. Проблема видообразования // Итоги науки и техники. Общая геология. Вып. 20. М.: ВИНИТИ, 1985. С. 1–94.
- Старобогатов Я.И., Левченко В.Ф. Экоцентрическая концепция макроэволюции // Журн. общей биологии. 1993. Т. 54. No 4. С. 389–407.
- Старобогатов Я.И., Левченко В.Ф. Возрастание биоразнообразия как основной путь эволюции экосистем // электронная публикация, 1999, ссылка: http: //www.evol.nw.ru/labs/lab38/levchenko/articles/biodiv.htm
- Жерихин В.В. Генезис травяных биомов // Экосистемные перестройки и эволюция биосферы. М.: Недра, 1994. С. 132–137.
- Красилов В.А. Происхождение и ранняя эволюция цветковых растений. М.: Наука, 1989. 264 с.
- Разумовский С.М. Закономерности динамики биоценозов. М.: Наука, 1981. 231 с.
- Разумовский С.М. Избранные труды: Сборник научных статей. М.: КМК Sci. Press, 1999. 560 с.
- Dobretsov N., Kolchanov N., Rozanov A., Zavarzin G. (Eds). Biosphere origin and evolution. Springer, 2008. 428 p.
- Мережковский К.С. Теория двух плазм как основа симбиогенезиса, нового учения о происхождении организмов // Уч. зап. Казанского ун та. 1909. Т. 76. 102 с.
- Фаминцын А.С. О роли симбиоза в эволюции организмов // Записки Императ. Академии наук. Физико-матем. отдел. Сер. VIII. Т. XX. No 3: Труды Ботан. лабор. Импер. Академии наук, No 9. 1907. С. 1–14.
- Воронцов Н.Н. Эволюция дарвинизма (Развитие эволюционных идей в биологии). М.: УНЦ ДО, 1999. 630 с.
- Margulis L. Origin of Eukaryotic Cells. New Heaven: Yale Univ. Press, 1970. 350 p.
- Райков И.Б. Ядро простейших. Морфология и эволюция. Л.: Наука, 1978. 328 с.
- Margulis L. Symbiotic Planet: A New Look at Evolution. Basic Books, 1999. 176 p.
- Cavalier Smith T. The neomuran origin of archaebacteria, the negibacterial root of the universal tree and bacterial megaclassification // Int. J. Syst. Evol. Microbiol. 2002. V. 52. No 1. P. 7–76.
- Cavalier Smith T. The phagotrophic origin of eukaryotes and phylogenetic classification of Protozoa // Int. J. Syst. Evol. Microbiol. 2002. V. 52. No 2. P. 297–354.
- Daubin V., Lerat E., Perriere G. The source of laterally transferred genes in bacterial genomes // Genome Biol. 2003. V. 4. No 9. Epub: http: // genomebiology.com/2003/4/9/R57
- Beiko R.G., Harlow T.J., Ragan M.A. Highways of gene sharing in prokaryotes // PNAS. 2005. V. 102. No 40. P. 14332–14337.
- Nesbo C.L., L’Haridon S., Stetter K.O., Doolittle W.F. Phylogenetic analyses of two “archaeal” genes in ther motoga maritima reveal multiple transfers between archaea and bacteria // Mol. Biol. Evol. 2001. V. 18. No 3. P. 362–375.
- Woese C.R. Interpreting the universal phylogenetic tree // PNAS. 2000. V. 97. No 15. P. 8392–8397.
- Woese C.R. On the evolution of cells // PNAS. 2002. V. 99. No 13. P. 8742–8750.
- Момыналиев К.Т. Геномно протеомная характеристика вариабельности Helicobacter pylori: Дисс. … докт. биол. наук. М.: НИИ Физ. хим. медицины минздравсоцразвития России, 2009. 242 с.
- Potgens A.J.G., Drewlo S., Kokozidou M., Kaufmann P. Syncytin: the major regulator of trophoblast fusion? Recent developments and hypotheses on its action // Hum. Reproduction Update. 2004. V. 10. No. 6. P. 487–496.
- Алимов А.Ф. (гл. ред.). Протисты. Руководство по зоологии. Часть 2. СПб.: Наука, 2007. 1144 с.
- Douglas S., Zauner S., Fraunholz M. et al. The highly reduced genome of an enslaved algal nucleus // Nature. 2001. V. 410. No 6832. P. 1091–1096.
- Карпов А.С. Некоторые свойства искусственно полученных симбиотических ассоциаций амеб с хлорофитовыми водорослями Chlorella sp. // Цитология. 1993. Т. 35. No 4. С. 127–133.
- Марков А.В., Куликов А.М. Происхождение эвкариот: выводы из анализа белковых гомологий в трех надцарствах живой природы // Палеонтологич. журн. 2005. T. 30б. No 4. С. 345–357.
- Richards T.A., Dacks J.B., Campbell S.A. et al. Evolutionary origins of the eukaryotic shikimate pathway: gene fusions, horizontal gene transfer, and endosymbiotic replacements // Eukaryot. Cell. 2006. V. 5. No 9. P. 1517–1531.
- Li S., Nosenko T., Hackett J.D., Bhattacharya D. Phylogenomic analysis identifies red algal genes of endosymbiotic origin in the chromalveolates // Mol. Biol. Evol. 2006. V. 23. No 3. P. 663–674.
- Embley T.M., Martin W. Eukaryotic evolution, changes and challenges // Nature. 2006. V. 440. No 7084. P. 623–630.
- Jekely G. Origin of phagotrophic eukaryotes as social cheaters in microbial biofilms // Biology Direct. 2007. V. 2. No 3 (E pub).
- Шестаков С.В. О ранних этапах биологической эволюции с позиции геномики // Палеонтологич. журн. 2003. No 6. С. 50–57.
- Шестаков С.В. Роль горизонтального переноса генов в эволюции // Доклад, прочитанный на теоретическом семинаре геологов и биологов “Происхождение живых систем” (15–20 августа 2003 г.). Горный Алтай, “Денисова Пещера”, 2003.
- Прозоров А.А. Альтруизм в мире бактерий? // Успехи соврем. биологии. 2002. Т. 122. No 5. C. 403–413.
- Engelberg Kulka H., Glaser G. Addiction modules and programmed cell death and antideath in bacterial cultures // Ann. Rev. Microbiol. 1999. V. 53. P. 43–70.
- Tamames J. Evolution of gene order conservation in prokaryotes // Genome Biol. 2001. V. 2. No 6. (E pub).
- Teichmann S.A., Babu M.M. Conservation of gene coregulation in prokaryotes and eukaryotes // Trends Biotechnol. 2002. V. 20. No 10. P. 407–410.
- Hooper S.D., Berg O.G. Duplication is more common among laterally transferred genes than among indigenous genes // Genome Biol. 2003. V. 4. No 8. Epub.
- Кордюм В.А. Эволюция и биосфера. Киев: Наук. думка, 1982. 261 с.
- Novikova O.S., Fet V., Blinov A.G. Horizontal transfer of non-ltr retrotransposons // Вестник ВОГиС. 2009. Т. 13. No 1. С. 76–83.
- Agrawal A., Eastman Q.M., Schatz D.G. Transposition mediated by RAG1 and RAG2 and its implications for the evolution of the immune system // Nature. 1998. V. 394. No 6695. P. 744–751.
- Берг Р.Л. Корреляционные плеяды и стабилизирующий отбор // Генетика и эволюция: Избр. труды. Новосибирск: Наука, 1993. С. 137–178.
- Берг Р.Л. Экологическая интерпретация корреляционных плеяд // Генетика и эволюция: Избр. труды. Новосибирск: Наука, 1993. С. 123–137.
- Page R.D., Clayton D.H., Paterson A.M. Lice and cospeciation: a response to Barker // Int. J. Parasitol. 1996. V. 26. No 2. P. 213–218.
- Gojobori T., Moriyama E.N., Kimura M. Molecular clock of viral evolution, and the neutral theory // PNAS. 1990. V. 87. No 24. P. 10015–10018.
- Родин С.Н. Идея коэволюции. Новосибирск: Наука, 1991. 271 с.
- Ратнер В.А. Внешние и внутренние факторы и ограничения молекулярной эволюции // Современные проблемы теории эволюции / Под ред. Татаринова Л.П. М.: Наука, 1993. С. 60–80.
- Nei M., Rooney A.P. Concerted and birth and death evolution of multigene families // Ann. Rev. Genet. 2005. V. 39. P. 121–152.
- Koonin E.V. Orthologs, paralogs, and evolutionary genomics // Ann. Rev. Genet. 2005. V. 39. P. 309–338.
- Shindyalov I.N., Kolchanov N.A., Sander C. Can three dimensional contacts in protein structures be predict ed by analysis of correlated mutations? // Protein Eng. 1994. V. 7. No 3. P. 349–358.
- Афонников Д.А., Колчанов Н.А. Консервативные особенности ДНК связывающих доменов класса “гомеодомен”, обусловленные коадаптивными заменами аминокислотных остатков // ДАН. 2001. Т. 380. No 5. С. 691–695.
- Afonnikov D.A., Kolchanov N.A. CRASP: a program for analysis of coordinated substitutions in multiple alignments of protein sequences // Nucl. Acids Res. 2004. V. 32. P. 64–68.
- Kann M.G., Shoemaker B.A., Panchenko A.R., Przytycka T.M. Correlated evolution of interacting proteins: looking behind the mirrortree // J. Mol. Biol. 2009. V. 385. No. 1. P. 91–98.
- Dodds P.N., Lawrence G.J., Catanzariti A.M. et al. Direct protein interaction underlies gene for gene specificity and coevolution of the flax resistance genes and flax rust avirulence genes // PNAS. 2006. V. 103. No 23. P. 8888–8893.
- Juan D., Pazos F., Valencia A. Co evolution and coadaptation in protein networks // FEBS Lett. 2008. V. 582. No 8. P. 1225–1230.
- Фомин С.В., Беркинблит М.Б. Математические проблемы в биологии. М.: Наука, 1973. 200 с.
- Лима де Фариа А. Эволюция без отбора: Автоэволюция формы и функции. М.: Мир, 1991. 455 с.
Источник «Генетика». 2012. Т.48. №5. С.573–589
[1] Так, стоит отметить, что сам Ч. Дарвин разделял не все тезисы современных дарвиновских теорий и в течение жизни менял свои взгляды, к концу жизни склонившись к механоламаркизму [2].
[2] Ж.Б. Ламарк, хотя и не использует термина “отбор”, но в неявной форме вводит отбор пар как обязательное условие эволюции, утверждая, что наследуются только те изменения, которые “общи обоим полам” и у обоих полов долгое время тренируются в одинаковом направлении. В природе по Ламарку это требование выполняется постоянно, а в человеческой популяции – лишь эпизодически, чем и объясняется отсутствие эволюции у современного Homo sapiens [6].
[3] Например, с мегадупликацией связывают приобретение S. cerevisiae анаэробного типа обмена [73], с последовательными раундами “полиплоидизация – потеря части копий” – эволюцию растений [74] и костистых рыб [75, 76].
[4] У многоклеточных с их обилием тканей и большими размерами гораздо больше шансов разнести экспрессию паралогов во времени и пространстве: лишь 8% генов у дрожжей остаются дуплицированными, остальные 92% возвращаются к состоянию одной копии, а у позвоночных, в среднем, остаются дуплицированными 50% генов [77].
[5] Так, тетраподный комплекс формировался независимо в разных линиях кистеперых рыб [96]. Формирование маммального комплекса стало генеральным трендом эволюции терапсид, но параллельно завершилось лишь в двух филумах – сумчатых и плацентарных [97]. Аналогично у диапсид орнитоидный комплекс полностью сформировался в филумах палеогнат и неогнат, хотя элементы его были широко распространены у динозавров [98]). Хорошо изу чено многократное параллельное формирование полного комплекса саблезубости (11 скоррелированных признаков) у сумчатых (Thylacosmilus), с одной стороны, и плацентарных (нимравиды, кошачьи), с другой [99].
[6] Отсюда и название – эпигенетическая (то есть надгенетическая) теория эволюции. При этом в термин “эпигенетика” включается вся регуляторная надстройка над генами (молекулярно генетическая, юкстакринная, паракринная, эндокринная), а не только регуляция экспрессии генов путем длительно сохраняющейся химической модификации нуклеотидов и/или хроматина.
[7] При этом надо отметить, что наряду с адаптивными новациями возникали морфозы, не только никак не связанные направлением отбора, но и объективно снижающие адаптацию особи (например, разная длина ног у лисиц). Таким образом, основной признак дарвиновской эволюции – стохастическая компонента – сохранялась.
[8] Как отмечал еще А.Г. Креславский [113]: “Вредное воздействие большинства мутаций на фенотип нейтрализуется поведенческими, физиологическими и морфогенетическими механизмами регуляции”. Отсюда можно дать определение нейтральной мутации. Любая мутация будет ней тральной, пока она не способна повлиять на регуляцию в генной сети [114]. Этот вывод подтверждает выявление не нулевой относительной вредности синонимичных замен, если вредность определить как реальную недопредставленность определенного класса мутаций по сравнению с теоретически возможной и за 100% принять вредность нонсенс мутаций [115].
[9] Ранее эти белки могли играть роль в делении клеток и/или в специализированных функциях (пенетрация вязкого субстрата или клеточной стенки потенциальной жертвы).
[10] Этот сценарий подтверждается выявлением многочисленных эндосимбионтов (в том числе и внутриядерных) у протистов [155] и многоступенчатого эндосимбиоза у хромофитовых водорослей [156]. В частности, хлоропласты помимо типичных для растений структур, общих с цианобактериями, содержат дополнительную мембрану и нуклеоморф – небольшое ядро с эукариотическим геномом, следовательно они являются потомками фотосинтезирующего эукариота, поглощенного их предком. Экспериментально симбиогенез исследовался на модели эндоцитосимбиотических ассоциаций “амеба–хлорелла” [157].
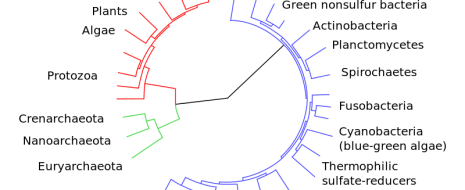
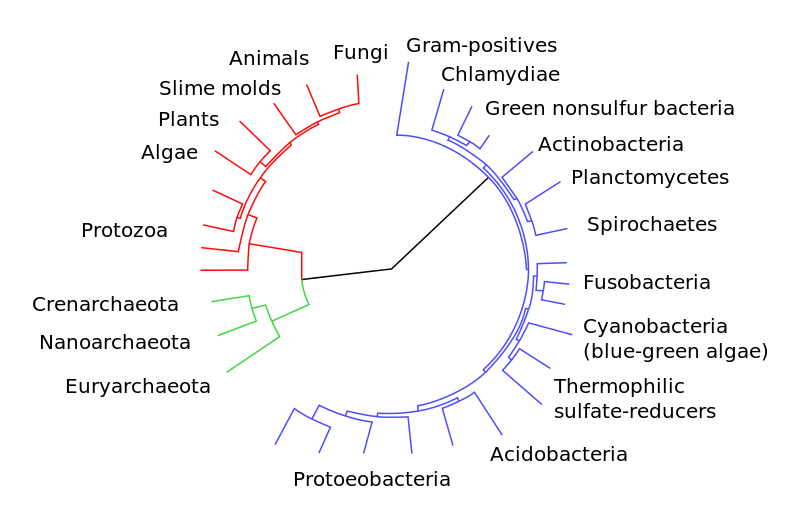
![Рис. 4. Формирование глобальных таксонов (по [146, 147] с изменениями по [139]).](http://www.socialcompas.com/wp-content/uploads/2016/03/4.jpg)