Клесты, зависящие от нерегулярно меняющихся урожаев семян хвойных, определяют их величину (решая вопрос, стоит ли задержаться на кормление) по непосредственно видимому обилию шишек, т.е. примерно так как натуралист оценивает его по шкале Каппера-Формозова
В последние 10-15 лет выяснилось, что действие экологических факторов (определяющих конкуренцию между видами, отношения «хищник-жертва», выбор местообитаний, мест гнездования, убежищ, микростаций, кормовых методов и т.д.) неизменно предваряется информационными, так что реакция на них опережающая, а не ответная. Животные оценивают риск нападения хищника, доступность корма в разных местообитаниях, обилие или, наоборот, редкость убежищ, мест для кормления, гнездования, ночлега, других значимых центров активности не по прямой стимуляции случаями охоты на них, успешных или неудачных кормлений в разных стациях и пр., т.е. не по прямому действию экологических факторов, а опосредовано, по сигналам-предвестникам. Ориентируясь на них, животные оценивают уровень риска или, наоборот, благоприятность местообитания |(рождается карта его субъективного качества, «с точки зрения данного вида и особи»), их же используют в выборе поведения в проблемной ситуации.
Сигналом может стать всякий компонент внешнего мира животного:
— непосредственно видимое и счётное обилие корма;— сами по себе особи вида-хищника, конкурента или мутуалиста, также как их помёт, гнезда, подолбы, порои, задиры, сурчины, шишки или орехи в дятловых «кузницах» и пр. следы жизнедеятельности. Всё это оказывается «сигналом присутствия»;
— их типическая активность в типической ситуации взаимодействия (токование, гнездостроение, яйцекладка, контактные или «охотничьи» крики, мочевые, каловые или иные метки в связи с этой активностью), т. е. всякая характерным образом изменённая среда обитания, позволяющая распознать, «кто это сделал» и «с какой целью/чем был здесь занят».
Что это значит? Обычная вещь, вовлечëнная в деятельность индивида, как самообеспечивающую, так и в особенности взаимодействие с социальными компаньонами, может восприниматься не как вещь, а как знак, сигнал или символ в меру типичности исполнения (=характерности образа и узнаваемости при восприятии). Как любой знак, она информирует о ситуации, управляет поведением, «сделавшим» именно эту часть внешнего мира особи из вещи символом.
Животные же (как и люди) своей деятельностью превращают разные объекты внешнего мира из вещей в знаки, управляющие их активностью — какие и как именно, рассказывается в трёх характерных примерах символического поведения, с разных сторон отражающих символическое восприятие внешнего мира разными видами позвоночных. Включая, что всего замечательней, использование мухоловками нейтральных символов, вроде кругов с треугольниками, которыми значимые объекты (гнёзда синиц, наблюдения за которыми позволяют определить «качество» данного места гнездования) метит экспериментатор. Больше, того, в оценке качества местообитания и выборе мест собственного гнездования мухоловки предпочитают ориентироваться по таким символам, нежели напрямую по успеху размножения в соответствующих гнездах синиц.
Последнее важно, ибо совсем недавно думали, что такое присуще лишь человеку разумному: гуманитарии (увы!) верят в это доселе.
Птицы, предупрежденные соседями о нехватке пищи, меняют физиологию и поведение, чтобы подготовиться
Содержание
Поведение клестов-еловиков Loxia curvirostra, ограниченных в пище в течение 3х дней, делается сигналом нехватки пищи для их соседей. И те реагируют адекватно, внутренне подготавливаясь к «тощим годам»: меняют физиологию и поведение так, что могут потребить больше даже недостаточной пищи, и лучше сохраняют массу тела и массу кишечника несмотря на голодание.
J.M.Cornelius (2022) показал, что социальная информация от голодавших соседей эффективно подготавливает птиц к голоду, с которым они сами столкнутся потом, улучшает кормление в этих условиях и тем самым повышает жизнеспособность. После получения социальной информации от соседей, у которых в течение трех дней были ограничения в еде, клесты, участвовавшие в исследовании, увеличили темп потребления, увеличили массу кишечника и сохраняют величину мышц, отвечающих за полет. Поэтому при последующем ограничении двумя короткими кормлениями в день эти «предупрежденные» особи интенсивней питаются, устойчивей сохраняют массу тела, жировые запасы и крыловые мышцы в условиях голода. Фактически сигналы-предвестники будущего стресса, генерируемые уже «захваченными» им особями, способны изменить обработку сигналов стресса, дошедшего до «предупрежденных» птиц, благодаря чему продлевается фаза эустресса, увеличивается способность действовать в ней и эффективность действий (Cornelius et al., 2018).
Корнелиус показал, что еловики, соседствующие с голодающими, сильней увеличивали уровень кортикостерона, когда их самих ограничивали в пище. Одновременно снижается экспрессия кортикостероидных рецепторов в контрольных областях мозга, повышая чувствительность гипоталамо–гипофизарно–надпочечниковой системы к стрессовым факторам, что подготавливает птицу к лучшему решительному реагированию на надвигающуюся проблему: активность мозга меняется так, что клесты при нехватке корма активней питаются. Т.е. наблюдение сытых особей за голодающими особями улучшает реакцию их на голод, когда они с ним столкнутся потом.
Клесты-еловики кочуют в зависимости от обилия пищи, семян хвойных, которое оценивают опираясь на социальную информацию — крики кормящихся птиц своей или чужой стаи, скорость потребления ими семян из шишек на данном дереве, чтобы принять решение, продолжить кормится или лететь дальше на поиски более урожайных мест. Стая использует и визуальную информацию об обилии корма на данном участке. Непосредственно видимый их недостаток ведёт к стресс-реакции с устойчивым подъёмом уровня кортизола раньше, чем её вызовет собственно уменьшение скорости потребления семян при кормлении или участившиеся из-за этого стычки внутри стаи. Визуальная оценка обилия или нехватки шишек (как их оценивает натуралист по шкале Каппера-Формозова) также модулирует уровень выброшенного кортикостерона (Cornelius et al., 2010).
Урожаи семян непредсказуемо меняются, поэтому с неожиданной нехваткой пищи полностью зависящие от них клесты сталкиваются намного чаще других вьюрковых. В вольерных экспериментах использовали две группы клестов, каждая из которых получала социальную информацию от голодавших особей («модели»). Однако первая (прогностическая) группа получала её за 3 дня до того, как её саму ограничат в пище, вторая — также 3 дня, но одновременно с их собственным голоданием. Социальная информация от «моделей» одна и та же в обоих группах, но различался контекст: в подготовительную фазу опытов в первой группе птицы имели сытых соседей, во второй голодных. В конце голодовки у птиц обоих групп отслеживали количество потребленного корма, массу тела, кишечника, крыловых мышц и жировые запасы, т. е. насколько эффективно они справились с голодом. Предсказуемо социальная информация первой группе помогла куда больше, чем второй.
Реакция жертв на следы пребывания хищника
Ещё до того, как популяция жертв начнёт реально нести потери от хищников, они начинают их бояться, и соответственно менять поведение — или чтобы выйти из-под воздействия страха, или как-то с ним жить.
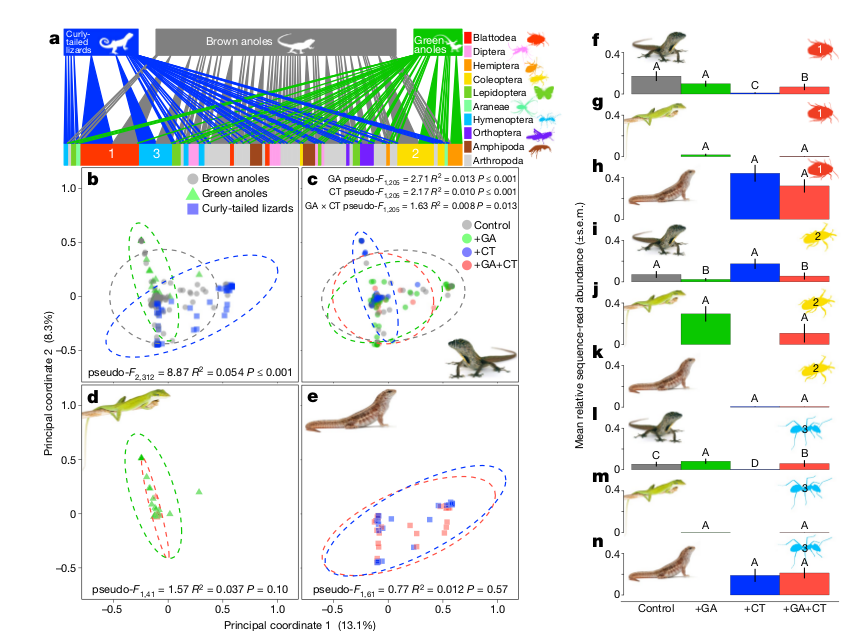
А это позволяет и хищникам и жертвам осуществлять опережающее отражение, сортироваться на выбравших одну тактику приспособления к данному экологическому фактору или другую ещё до того, как отбор (в виде хватающего жертв хищника) реально начнёт действовать. Межвидовая конкуренция также предваряется и опосредуется сигналами-предвестниками, показывающими обоим видам наличие в данной местности более сильного или, наоборот, более слабого конкурента, что даёт возможность опережающего отражения. Очень красивый пример этого, мне неизвестный, нашёл студент при сдаче зачёта (всякое обучение — процесс взаимный). На малых островах Карибского моря, где хищники «на вершине» экологической пирамиды — только ящерицы, живёт бурый анолис Anolis sagrei. Pringle et al. (2019) заселяли на эти острова его конкурента — зелёного анолиса Anolis smaragdinus, а иногда также ещё более крупного хищника — килеватую масковую игуану Leiocephalus carinatus, жрущую наряду с разными беспозвоночными и обоих анолисов (рис.1).
Рисунок 1. Изученные виды и план опыта. Обозначения. а–с, изученные виды: бурый анолис A.sagrei (а), зеленый анолис А.smaragdinus (b) и килеватая масковая игуана L. carinatus (c). d. район исследования (желтый квадрат) в цепи островов Эксума, Багамы (белый силуэт), и размещение 16 островов, на которых ставили опыты, вблизи Станиэл-Кей. (спутниковый снимок). Цвета — варианты опытов (g), реализованные на разных островах (по 4 острова для каждого варианта): серый — контроль (только бурый анолис), зелёный, +GA (добавили зелёного анолиса), синий, +CT (добавили игуану), красный, +GA, CT (зелёный анолис и игуана). WBC, White Bay Cay. e–f, фото сбоку (e) и сверху (f) одного из экспериментальных островов (922, площадь растительности 1648 м2 (среднее по экспериментальным островам — 1635 м2), куда вселили GA и СТ. Лодка длиной 5,5 м показывает масштаб.
Зелёный анолис живёт на деревьях, бурый — на деревьях и на земле, игуана — на земле. Вселение конкурента и хищника радикально меняло динамику популяций, пространственную и трофическую ниши жертв ещё до ощутимости чисто экологических следствий от их вселения (рис.2-3). Численность игуаны везде растёт, нет статистических различий между островами с зелёным анолисом и без них; численность зелёных анолисов после вселения сильно растёт (>чем в 8 раз) лишь при отсутствии игуаны, но практически не растёт при её наличии. Траектории динамики популяций зелёных анолисов на разных островах показывают чёткую бифуркацию: в отсутствие игуаны численность растёт кратно, на островах с игуаной одна популяция возрастает, хотя и медленней, остальные поддерживаются на низком уровне и не увеличивают численность, две вообще вымерли через несколько лет после опытов (начатых в 2012 г.).
 Рисунок 2. Динамика численности разных ящериц в разных вариантах опыта. а. Вселённые популяции игуан равно выросли численно (нет значимой разницы, t = 0,40, P = 0,70, df = 5, n = 7 островов) на островках с (+GA+CT) и без (+CT) зеленых анолисов. b. в среднем, интродуцированные популяции зеленых анолисов выросли более чем 8кратно на островах +GA, но не увеличились на островах +GA+CT (t = -2,81, P = 0,031, df = 6, n = 8 островов). c. Динамика численности зелёных анолисов на каждом из островов: виден рост в 5-15 раз везде, где нет игуан, но где они есть, рост выявлен лишь у одной популяции, еще одна была в целом стабильна, 2 вымерли за 6 лет наблюдений (на острове 312 — в январе 2017 года, уже после последнего учёта, красный пунктир). Масштаб оси ординат логарифмический. d, Численность бурых анолисов (численность относительно таковой 2011 года, предшествовавшего опытам) на контрольных островах в 2011-2016 гг. выросла почти втрое, однако упала на островах с хищниками и конкурентами. Различия значимы: в присутствии хищника t = -7,49, P < 0,001; конкурента t = -5,49, P < 0,001; обоих t = 2,67, P = 0,024; всего df = 10, n = 14 островов). В a, b и d приведены средние ± 1 стандартная ошибка средней для n = 7 или 8 островов (игуаны), n = 8 островов (зеленые) и n = 14, 15 или 16 островов (бурые анолисы). Все оценки значимости различий — двусторонний t-тест, основанный на обобщенных линейных моделях наименьших квадратов для данных последнего учёта численности 2016 г.
Рисунок 2. Динамика численности разных ящериц в разных вариантах опыта. а. Вселённые популяции игуан равно выросли численно (нет значимой разницы, t = 0,40, P = 0,70, df = 5, n = 7 островов) на островках с (+GA+CT) и без (+CT) зеленых анолисов. b. в среднем, интродуцированные популяции зеленых анолисов выросли более чем 8кратно на островах +GA, но не увеличились на островах +GA+CT (t = -2,81, P = 0,031, df = 6, n = 8 островов). c. Динамика численности зелёных анолисов на каждом из островов: виден рост в 5-15 раз везде, где нет игуан, но где они есть, рост выявлен лишь у одной популяции, еще одна была в целом стабильна, 2 вымерли за 6 лет наблюдений (на острове 312 — в январе 2017 года, уже после последнего учёта, красный пунктир). Масштаб оси ординат логарифмический. d, Численность бурых анолисов (численность относительно таковой 2011 года, предшествовавшего опытам) на контрольных островах в 2011-2016 гг. выросла почти втрое, однако упала на островах с хищниками и конкурентами. Различия значимы: в присутствии хищника t = -7,49, P < 0,001; конкурента t = -5,49, P < 0,001; обоих t = 2,67, P = 0,024; всего df = 10, n = 14 островов). В a, b и d приведены средние ± 1 стандартная ошибка средней для n = 7 или 8 островов (игуаны), n = 8 островов (зеленые) и n = 14, 15 или 16 островов (бурые анолисы). Все оценки значимости различий — двусторонний t-тест, основанный на обобщенных линейных моделях наименьших квадратов для данных последнего учёта численности 2016 г.
Численность бурого анолиса выросла более чем второе в контроле, по сравнению с ситуацией на начало опытов в 2011 г., стабильная в присутствие зелёного конкурента, с которым они делят пространственную и трофическую нишу (бурый больше кормится на земле, зелёный — на деревьях, рис.4-5). В присутствие только хищника численность бурых анолисов также стабильна, но на более низком уровне: страх перед хищником гонит его на деревья, где он менее эффективен. А вот сосуществование с зелёным конкурентом и игуаной обрушивает популяцию бурого анолиса: страх перед хищников заставляет его отступать в свободные от него рефугиумы, средняя высота охотничьих микростаций в его присутствии подскакивает более чем вдвое (рис.3).
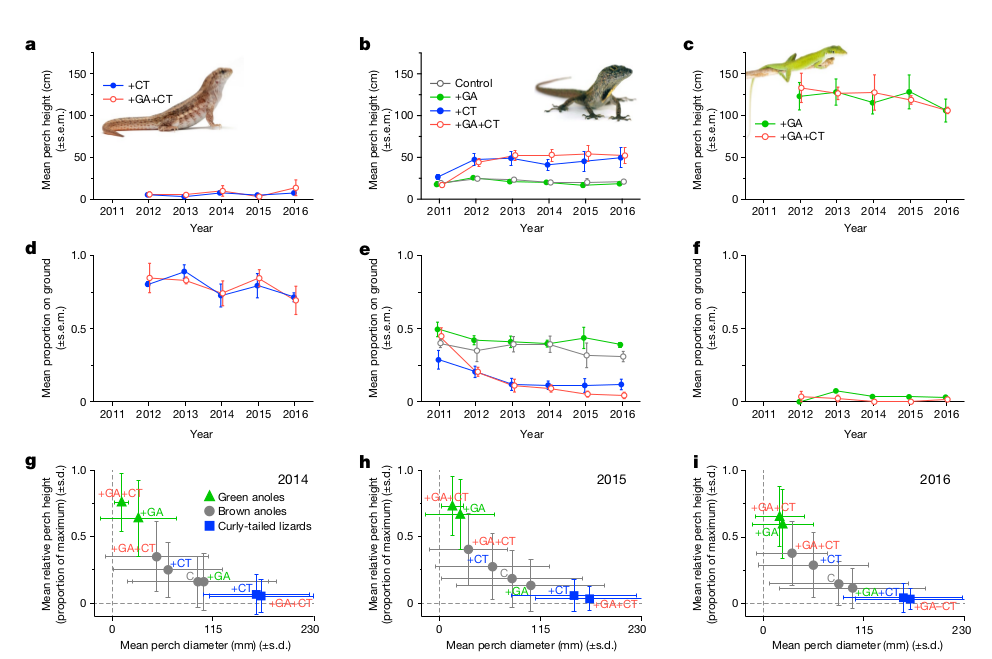 Рисунок 3. Индуцированный хищником коллапс пространственной ниши бурого анолиса. а–с, средняя высота присад игуан (слева), бурых (в середине) и зеленых анолисов (справа,везде в см) в разных вариантах опыта. Видно быстрое удвоение высоты присад бурых анолисов в присутствии одного хищника (+CT) или хищника и конкурента, +GA+CT (эффект хищника t = 2,71, P = 0,02; конкурента t = -1,79, P = 0,10; обоих t = 0,31, P = 0,76; все df = 11, n = 15 островов), ниши двух других видов значимо не меняются. d–f, Средняя доля особей, отмеченных на земле; у бурых анолисов значимые различия в разных вариантах опыта (присутствие хищника t = -3,82, P = 0,003; конкурента t = 2,13, P = 0,056; обоих t = -2,88, P = 0,015; всего df = 11, n = 15 островов). g–i, изменения объема пространственной ниши (по двум осям — относительная высота присады, отношение её высоты к максимальной доступной высоте растительности, и диаметр присады) — для каждого вида (символы) и варианта опыта (буквы) с 2014 по 2016 год. с. контроль.
Рисунок 3. Индуцированный хищником коллапс пространственной ниши бурого анолиса. а–с, средняя высота присад игуан (слева), бурых (в середине) и зеленых анолисов (справа,везде в см) в разных вариантах опыта. Видно быстрое удвоение высоты присад бурых анолисов в присутствии одного хищника (+CT) или хищника и конкурента, +GA+CT (эффект хищника t = 2,71, P = 0,02; конкурента t = -1,79, P = 0,10; обоих t = 0,31, P = 0,76; все df = 11, n = 15 островов), ниши двух других видов значимо не меняются. d–f, Средняя доля особей, отмеченных на земле; у бурых анолисов значимые различия в разных вариантах опыта (присутствие хищника t = -3,82, P = 0,003; конкурента t = 2,13, P = 0,056; обоих t = -2,88, P = 0,015; всего df = 11, n = 15 островов). g–i, изменения объема пространственной ниши (по двум осям — относительная высота присады, отношение её высоты к максимальной доступной высоте растительности, и диаметр присады) — для каждого вида (символы) и варианта опыта (буквы) с 2014 по 2016 год. с. контроль.
Если там есть и зелёный конкурент, происходит коллапс популяции одного из анолисов: даже не само хищничество, но только страх перед ним обрушивает устойчивое сосуществование двух конкурирующих видов (вместо стабилизации, предполагаемой в экологической теории), ибо ликвидирует разделение ниш, сложившееся в его отсутствие. Средняя высота ветвей, используемых для охоты игуаной, бурым и зелёным анолисом при разном сочетании данных видов, у бурого анолиса более чем двукратно растёт в присутствии хищника, у зелёного же не меняется (он использует самые высокие и узкие присады); лишь у бурых анолисов доля особей, охотящихся на земле, значимо различалась в зависимости от сочетания видов в опыте, на островах +GA+GT он вторгся в пространственную нишу зелёных.
Рисунок 4. Экспериментально обусловленный сдвиг и перекрывание трофических ниш показывает обострение конкуренции за пищу. а — двусторонняя пищевая сеть, показывает 50 основных таксонов-жертв (внизу, выделены по таксономическим группам) для всех видов ящериц (вверху). Получена ДНК-метакодированием фекалий n = 315 отдельных особей, представляющих все варианты опыта. Данные 50 видов корма объемлет 82-87% общего рациона каждого вида. Ширина соединительных линий — относительная представленность в спектре кормов. Цифры — три самых обычных вида корма (1 — наземный таракан H. pabulator; 2 — древесный жук A. floridanus; 3 — земляные муравьи Brachymyrmex spp.). B–d, Координатный анализ Брэя–Кертиса [метод, проецирующий относительные сходства или различия между выборками на двумерную плоскость основных координат] показывает различия рационов в разных видах и вариантах опыта.
Точки — отдельные образцы (расстояние отражает различия); эллипсы — 95% доверительные интервалы. Для лучшего сравнения все графики сделаны по одной ординации и с одинаковыми координатами, но доверительные интервалы для разных вариантов опыта в с-е считали отдельно. F-статистика в b- перестановочный многомерный дисперсионный анализ (PERMANOVA), проверяет влияние принадлежности к каждому из трёх видов на спектр кормов (P ≤ 0,001, n = 315 образцов). F- статистика в c — то же самое, оценка влияния разных вариантов опыта (+GA, +CT, оба) на спектр кормов бурого анолиса (все Р ≤ 0,013, n = 209 образцов). F- статистика в d — влияние присутствия хищника на спектр кормов зелёного анолиса (Р = 0,10, n = 43 выборки). F- статистика в e — влияние зелёного анолиса на спектр кормов (P = 0,57, n = 63 образца). f–n, присутствие трёх главнейших кормов (относительное обилие) у разных видов и в разных вариантах опыта: H. pabulator (f–h), A. floridanus (i–k) и Brachymyrmex spp. (l–n). Столбцы — среднее относительное обилие ±1 se; размеры выборок для каждого вида соответствуют показателям на с-е. Буквы — статистически значимые различия в парных сравнениях разных вариантов опыта, статистика Вальда (все значимые эффекты P ≤ 0,042; все незначимые эффекты P > 0,066).
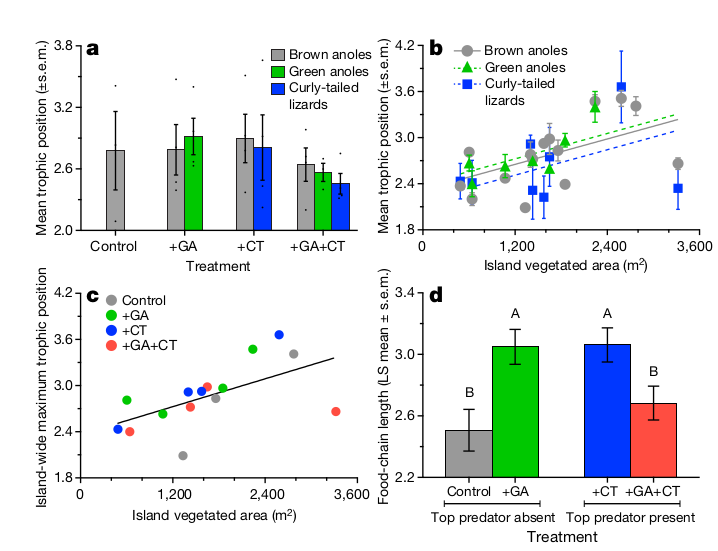 Рисунок 5. Положение вида в пищевой цепи (ордината) и её длина. а. Показано положение в пищевой цепи каждого вида в разных вариантах опыта, без учета влияния площади острова. Представлены средние ±1 se, рассчитанные по средним значениям для каждого острова, представляющего разные варианты опытов (их n = 3 в контроле; n = 4 островка для всех других случаев). Точки — значения для каждой популяции. b. Среднее положение в пищевой цепи каждого острова разных видовых популяций, в зависимости от площади растительности. Последняя влияет значимость, а вот видовая принадлежность нет, см. анализ ковариаций ANCOVA: F-статистика для площади острова F1,26 = 9,73, P = 0,0044; для вида F2,26 = 0,65, P = 0,53; n = 30 популяций. c — Удлинение пищевой цепи с ростом площади островков; точки, n = 15. Окраска соответствует вариантам опыта. линейная регрессия r = 0,59, F1,13 = 6,82, P = 0,022. d — Средняя длина пищевой цепи островка (±1 SE) в каждом варианте опыта после учета влияния площади островка и всех взаимодействий первого порядка (расширенная таблица данных 2а).
Рисунок 5. Положение вида в пищевой цепи (ордината) и её длина. а. Показано положение в пищевой цепи каждого вида в разных вариантах опыта, без учета влияния площади острова. Представлены средние ±1 se, рассчитанные по средним значениям для каждого острова, представляющего разные варианты опытов (их n = 3 в контроле; n = 4 островка для всех других случаев). Точки — значения для каждой популяции. b. Среднее положение в пищевой цепи каждого острова разных видовых популяций, в зависимости от площади растительности. Последняя влияет значимость, а вот видовая принадлежность нет, см. анализ ковариаций ANCOVA: F-статистика для площади острова F1,26 = 9,73, P = 0,0044; для вида F2,26 = 0,65, P = 0,53; n = 30 популяций. c — Удлинение пищевой цепи с ростом площади островков; точки, n = 15. Окраска соответствует вариантам опыта. линейная регрессия r = 0,59, F1,13 = 6,82, P = 0,022. d — Средняя длина пищевой цепи островка (±1 SE) в каждом варианте опыта после учета влияния площади островка и всех взаимодействий первого порядка (расширенная таблица данных 2а).
Данные — средние значения, оцененные в по методу наименьших квадратов (LS) ± 1 se. в варианте взаимодействия зеленого анолиса с игуаной с использованием обобщенной линейной модели регрессии (скорректированный R2 = 0,73, F6,8 = 7,35, P = 0,0064; t взаимодействия хищника и конкурента = -3,86, df = 8, P = 0,0048; n = 15 островов). Буквы — статистически значимые различия (Р ≤ 0,05) между вариантами опыта в парных двусторонних t-тестах. Полная модель (таблица расширенных данных 2а) также включала значимое взаимодействие между площадью островов и вариантами опыта, что отражает отсутствие увеличения длины пищевой цепи с увеличением размера экосистемы на островах +GA+CT (c; см. также расширенные данные на рис. 7). Результаты на этом рисунке основаны только на ящерицах; качественно эквивалентные анализы, включающие доминирующий вид пауков, Metepeira datona (Araneidae), приведены на рис. 6 с расширенными данными и в таблице 2b с расширенными данными.
Хищник препятствует сосуществованию двух видов анолисов, уменьшая размерность их ниш, обостряя трофическую и топическую конкуренцию, чем подталкивает отдельные популяции к вымиранию. Главнейшая роль в этом эффекте играет не самое охота, а внешний вид хищника. Значительное пересечение ниши бурого анолиса с зелёным в присутствии хищника также сильней подрывает жизнеспособность популяций первого вида. Игуаны могут питаться членистоногими, не только ящерицами, их численность растёт и при сокращении численности анолисов, что обеспечивает постоянный риск нападения игуан. Тем самым они одновременно конкурируют с бурым анолисом за пищу, поэтому на островах + GA+GT длина пищевой цепи сократилась, несмотря на добавление верховного хищника. Вместо того, чтобы увеличивать доступность ресурсов для зеленых анолисов вследствие уменьшения численности бурых, хищник фактически уменьшил её, загнав бурых анолисов на деревья.
Опережающее отражение в реакциях особей на сигналы-предвестники, показывающие большую привлекательность одних территорий перед другими (или, наоборот, больший страх) радикально меняет взгляд на роль отбора в эволюции. Особи в популяции разнокачественны, в том числе по реакциям на сигналы привлекательности или страха, присутствующие в среде обитания и создающие им своего рода карту местности, показывающую анизотропность среды с точки зрения её качества в разных аспектах существования особей, так называемые ландшафты привлекательности и/или страха.
Пандемия коронавируса 2020 г. стала естественным экспериментом, показавшим огромную важность «ландшафтов страха», созданных активностью людей, для «городских» популяций млекопитающих и птиц. Карантин и другие противоэпидемические мероприятия сильно снизили посещаемость всех мозаик урболандшафта, от природных территорий до кварталов застройки. Обитающие здесь виды стали активны в местах, которых в присутствии людей избегали, и в часы, когда раньше прохожие их там не видели. Это не недавно вселившиеся, а местные особи, их поведение отражает прекрасное знание территории, просто в обычном режиме «городского метаболизма» они жили незаметно для обывателей — как европейский тювик Accipiter badius в Предкавказье и другие успешные синурбанисты.
Реагируя на эти сигналы, особи разного качества «сортируются» взад-вперёд по обоим градиентам, благодаря чему каждая оказывается в среде, наиболее подходящей именно ей; ранее единая популяция делится на две различающиеся между собой, т.е. дивергирует ещё до того, как соответствующий экологический фактор подействует. Отбор здесь превращается из движущего в стабилизирующий: ему осталось лишь «закрепить» эти различия, сама дивергенция (образующая элементарное эволюционное явление, если иметь в виду процесс, и созданную им новизну, если результат) создана именно и только активностью особей, оценивающих среду обитания и друг друга как часть последней.
Здесь я вижу возможности возрождения номогенетических моделей эволюции, и «возвращения» организма в эволюционную теорию, где он пока что отсутствует: есть генные частоты, популяции, экологические ниши в экосистеме; но при всей важности происходящего на этих уровнях, выживает, размножается, реагирует на среду обитания (включая социальных партнёров) именно организм, который целостен, управляет собой сверху донизу, от сложных форм поведения («разведки эволюции» по К.Н.Благосклонову) до уровней генной экспрессии. Благодаря этому он хуже или лучше, но «умеет» интегрально оценивать качество изменённой среды обитания по уровню стресса, развившегося при попадании туда, и «качество» собственного реагирования на эти стрессирующие изменения, чтобы потом выбирать поведение на основании этих оценок, прежде всего инвазировать в новую/изменённую среду обитания, и приспосабливаться к её часто экстремальным условиям или отступать назад, внутрь привычных местообитаний, с риском исчезнуть, когда это пространство сократится до минимума (это так называемая катастрофа эндемизма).
Мухоловки используют нейтральные символы в оценках «качества» мест гнездования
Самый красивый пример использования животными символов вот уже лет 15 интенсивно исследуют финны на примере выбора места для гнезда у мухоловок-пеструшек Ficedula hypoleuca или белошеек F.albicollis. Прилетая позднее, они наблюдают за выбором мест гнездования оседлыми большими синицами Parus major (или лазоревками P.caeruleus, или московками P.ater). Синицы и мухоловки гнездятся в одних и тех же дуплянках на одних и тех же лесных участках, однако к прилёту мухоловок у синиц уже есть кладка.
Последнее важно, ибо дуплогнёздники регулярно осматривают дупла друг друга и вообще разные дупла, имеющиеся на данном участке, равным образом в гнездовой и послегнездовой периоды (Ильина, 2019). Данное поведение, однотипно с дальними исследовательскими выходами владельцев постоянных участков обитания, редкими, но регулярными. Больший или меньший размер видимой кладки, своего рода маркёр «качества» мест гнездования, заставляет вид-«наблюдатель» повторять или ингибировать выбор вида-«модели».
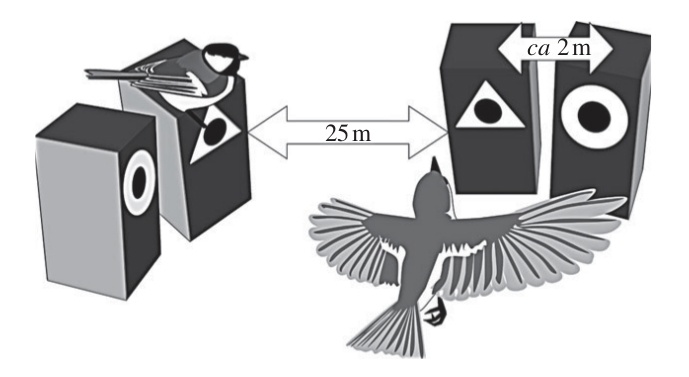
Используя простенький, очень красивый дизайн опытов, Seppänen et al. (2011) показали, что в выборе места для гнезда мухоловки используют не только внешний облик происходящего (скажем, поселяясь, в таких же дуплянках, на таких же участках леса, что и успешные пары синиц), но руководствуются именно нейтральными символами, кругом или треугольником, немедленно переходя на них как только возможно. Ими исследователь по определённой схеме метит дуплянки, занятые и пустые, так что среди пустых «наблюдавшие» за синицами мухоловки выбирают гнездовья между мечеными разными символами.
Forsman et al. (2022) сперва делали так, как будто «модель» — синицы — при выборе мест гнездования исходила из тех же альтернатив (треугольник vs круг). На данном участке леса дуплянки, занятые синицами, маркировали одним и тем же символом (скажем, кругом), а рядом, в 6-10 м., вешали пустую дуплянку, маркированную противоположным. Синицы территориальны и весьма агрессивны, поэтому мухоловки гарантированно не поселятся во второй дуплянке рядом с синицами, а могут лишь на неё смотреть наряду с занятой. Всё это создаёт иллюзию, что «модель» выбирала из этих альтернатив.
Чтобы избежать предпочтений облика используемых символов как такового (а вдруг круг синицами или мухоловкам нравится больше треугольников, и наоборот?), на соседнем участке леса занятые синицами гнездовья маркировали противоположным символом. Лицевую сторону дуплянок выкрашивали чёрным для большей контрастности с белыми символами. К прилёту мухоловок в 25-30 м. от гнездовых пар синиц (около каждой из них была пустая дуплянка с символом противоположным отметке на ней самой) развесили пары пустых дуплянок, меченых этой же самой парой символов.
Дуплянки для выбора мухоловок располагались на расстоянии около 2 м друг от друга: самцы мухоловок — пеструшек и белошеек также территориальны, поэтому самка поселится только в одной из двух. С этого расстояния хорошо видно гнездовье, выбранное синицами, но их агрессивность уже недостаточна, чтобы помешать мухоловкам занять какую-то из двух гнёзд (после периода поиска и оценки имеющихся, в ходе которого птицы инспектируют все находящиеся в данной местности в том числе занятые).
Так в опытах мухоловки подталкивались одновременно
а. к наблюдению за гнездящимися синицами с использованием их выбора как основы для собственного. Копируется он или ингибируется, заменяясь на противоположный, здесь не очень существенно, важно предпочтение выбора вида-модели вместо собственного восприятия и оценки местообитаний как таковых.
б. к выбору места для гнезда именно на основе альтернатив, маркированных нейтральными символами. Важный момент: сам такой выбор происходит спонтанно, он не сопровождается подкреплением положительным или отрицательным, в отсутствии склонности или готовности выбирать именно на основе символов птицы легко могут руководствоваться любыми иными аспектами выбора вида-«модели» или действовать независимо от него, однако при наличии символов, маркирующих альтернативы, они используют именно их.
Данные 4 дуплянки (пара для выбора, уже сделанного видом-моделью и пара для выбора мухоловками) составляли единичный комплект для тестирования последних. Другое тестирование других мухоловок проводили на расстоянии не менее километра от данного чтобы опыты были независимы друг от друга. Выяснилось, что в выборе мест гнездования мухоловки руководствуются именно символами, т.е. для себя выбирают дуплянку меченную также как у «модели» (копирование, повторение выбора) или альтернативным символом (ингибирование выбора синиц со сменой его на противоположный). Первое доминирует, если «модели» успешны, у них много птенцов в выводке, второе — если нет, и птенцов у них мало.
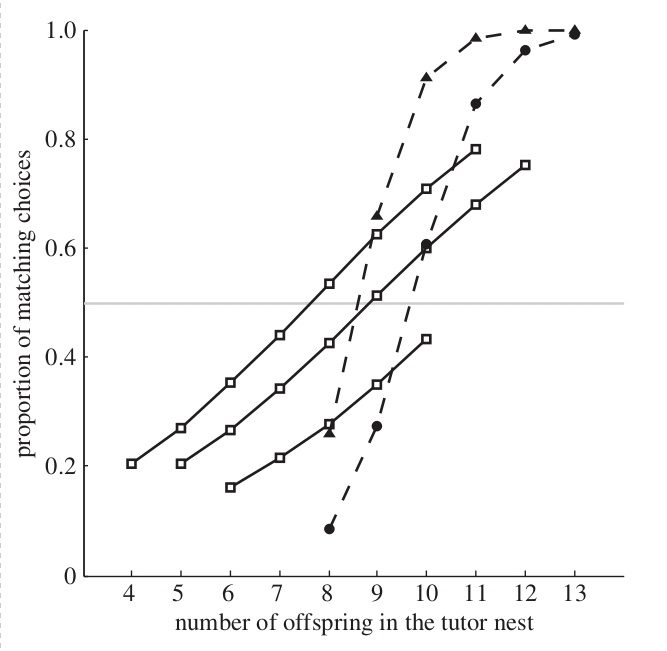 См. рисунок зависимости доли повторенных мухоловками выборов от числа птенцов в выводках у синиц. Сплошные линии и пустые значки — данные по Финляндии (3 района), штриховые и заполненные — по Латвии (1 район: видно что в этих двух регионах зависимости однотипны (в обоих случаях выбор осуществляется на основе нейтральных символов), при явных количественных различиях в силе и точности копирования/ингибирования выбора (зависимости построены по логистической регрессии). Разный угол наклона регрессий в разных регионах может быть связан с тем, сколько гнёзд синиц осматривает мухоловка, прежде чем сделать выбор (чем больше, тем он точнее), что в свою очередь зависит от длительности периода между прилётом и яйцекладкой (чем он длиннее, тем больше), что, в свою очередь, зависит от хода весны.
См. рисунок зависимости доли повторенных мухоловками выборов от числа птенцов в выводках у синиц. Сплошные линии и пустые значки — данные по Финляндии (3 района), штриховые и заполненные — по Латвии (1 район: видно что в этих двух регионах зависимости однотипны (в обоих случаях выбор осуществляется на основе нейтральных символов), при явных количественных различиях в силе и точности копирования/ингибирования выбора (зависимости построены по логистической регрессии). Разный угол наклона регрессий в разных регионах может быть связан с тем, сколько гнёзд синиц осматривает мухоловка, прежде чем сделать выбор (чем больше, тем он точнее), что в свою очередь зависит от длительности периода между прилётом и яйцекладкой (чем он длиннее, тем больше), что, в свою очередь, зависит от хода весны.
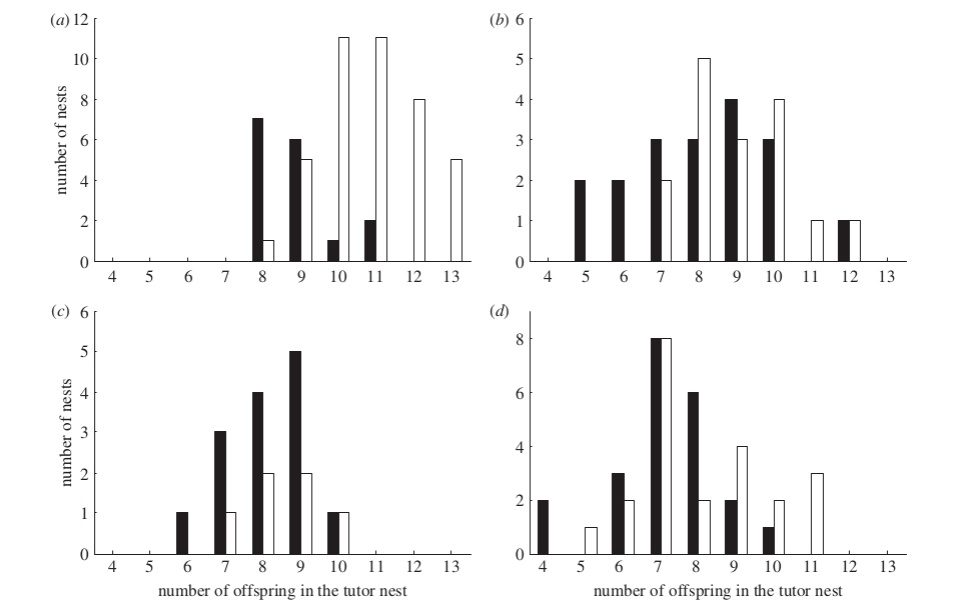 Эта картина неизменно фиксируется во всех 4-х повторностях опытов, см. подробней распределения частот опосредованных символами копирований vs ингибирований мухоловками выбора вида-модели во всех 4-х повторностях опытов (3 района в Финляндии 1 в Латвии). Ось Х рисунка — число птенцов в гнезде вида-модели, чёрные столбцы — число самок мухоловок, выбравших дуплянки с тем же символом, что модель, белые — число мухоловок, выбравших дуплянку с противоположным. Важно, что при «модели» низкого качества выбор «наблюдателя» делается альтернативным, но не происходит отказа от использования модели в пользу собственного выбора (или выбора на случайной основе). Данное поведение распространяется и на конспецификов: у мухоловки-белошейки наблюдение уменьшенного числа птенцов в выводке ослабляет территориальные связи с данным участком леса: иммиграция туда сокращается, эмиграция усиливается. Это же верно для непрямых сигналов о повышенном риске гибели гнезда именно в данном участке леса, причём в реакции есть межиндивидуальные различия: одни особи избегают таких мест, другие, наоборот, гнездятся там в среднем на 4 дня раньше и делают кладку на 10% больше (Mönkkönen et al., 2009). C таким же опосредованием символами белошейки копируют выбор раньше гнездящихся особей своего вида: ни опыт гнездования, ни возраст здесь не существенны, т.е. эта способность врождённа, существующее наряду с готовностью прослеживать выбор синиц и использовать его как модель собственного (Kivelä et al., 2014).
Эта картина неизменно фиксируется во всех 4-х повторностях опытов, см. подробней распределения частот опосредованных символами копирований vs ингибирований мухоловками выбора вида-модели во всех 4-х повторностях опытов (3 района в Финляндии 1 в Латвии). Ось Х рисунка — число птенцов в гнезде вида-модели, чёрные столбцы — число самок мухоловок, выбравших дуплянки с тем же символом, что модель, белые — число мухоловок, выбравших дуплянку с противоположным. Важно, что при «модели» низкого качества выбор «наблюдателя» делается альтернативным, но не происходит отказа от использования модели в пользу собственного выбора (или выбора на случайной основе). Данное поведение распространяется и на конспецификов: у мухоловки-белошейки наблюдение уменьшенного числа птенцов в выводке ослабляет территориальные связи с данным участком леса: иммиграция туда сокращается, эмиграция усиливается. Это же верно для непрямых сигналов о повышенном риске гибели гнезда именно в данном участке леса, причём в реакции есть межиндивидуальные различия: одни особи избегают таких мест, другие, наоборот, гнездятся там в среднем на 4 дня раньше и делают кладку на 10% больше (Mönkkönen et al., 2009). C таким же опосредованием символами белошейки копируют выбор раньше гнездящихся особей своего вида: ни опыт гнездования, ни возраст здесь не существенны, т.е. эта способность врождённа, существующее наряду с готовностью прослеживать выбор синиц и использовать его как модель собственного (Kivelä et al., 2014).
Насколько можно судить в выборе мест гнездования мухоловки руководствуются именно символами на дуплянках вида-модели: включение дополнительной информации о поле, возрасте или весе синиц (влияющих, скажем, на качество их родительского поведения) не увеличивало объяснительной силы модели и данные факторы были незначимы.
В более ранних опытах все гнёзда синиц на определённом участке леса маркировали одним и тем же символом, пустые дуплянки рядом — противоположным. Здесь мухоловки, прилетевшие позже, были более склонны копировать выбор синиц, чем прилетевшие ранее, очевидно, в связи с более напряжённым временным расписанием их репродукции, меньшим временем на самостоятельное обследование территории (и/или поскольку видели лишь завершённые, самые крупные кладки синиц, а раньше прилетевшие больше наблюдали неполных). Дальше вполне предсказуемо выяснилось, что взрослые птицы делают выбор с использованием символов много точнее, чем первогодки, а точность подобного выбора позитивно связана с уровнем интеллекта, сильно варьирующего между парами (у самок, но не самцов: они выбирают дупла и регулируют размер кладки). Но это уже отдельная тема.